Quanto è utile/interessante questa discussione:
| Autore |
Discussione |
|
|
Gigietto
Nuovo Arrivato

3 Messaggi |
 Inserito il - 14 maggio 2019 : 16:50:08 Inserito il - 14 maggio 2019 : 16:50:08



|
Ciao a tutti, mi rivolgo a voi nella speranza che possiate farmi vedere la luce in fondo al tunnel.
Faccio clonaggi ormai da tempo, ma questo proprio non ne vuole sapere di riuscire. Ecco alcuni dettagli, controlli, e dubbi:
Amplifico l'inserto per PCR con primer per l'inserimento di XhoI/SalI fiancheggiati da 3-4bp per il taglio enzimatico; purifico banda da gel; taglio con gli enzimi; heat inactivation e purifico l'inserto su colonnina.
Taglio vettore con gli stessi enzimi; heat inactivation e defosforilo (visto che gli enzimi sono pure compatibili); purifico vettore da gel.
Ligazione di 50ng di vettore (3200bp) con 65ng inserto (1400bp) (3:1 ins/vec ratio) in 20ul di reazione finale; incubo a 25°C 2h (provato anche 16°C o.n.); controllo la ligazione su gel, e sembra ci sia un ligato delle dimensioni attese (vedi immagine allegata); trasformo 50ul di DH5alfa con 5-10ul di reazione.
No colonies (o al massimo 3-4 colonie risultate vettore vuoto oppure mostri)!
Qualcuno ha idee o consigli? Estrazione della banda da gel su transilluminatore in modalità "analitical" piuttosto che "preparative" potrebbe essere il problema o solo una paranoia? Secondo voi la quantità di ligato è da considerarsi sufficiente o la ligazione è poco efficiente?
Grazie a chiunque possa aiutare!
Immagine:
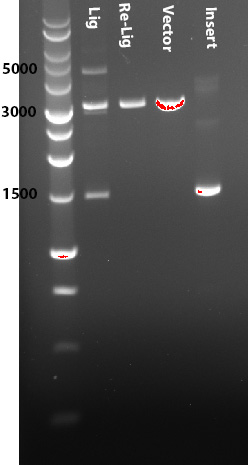
33,31 KB
|
|
|
|
|
domi84
Moderatore
  

Città: Glasgow

1724 Messaggi |
 Inserito il - 19 maggio 2019 : 18:46:57 Inserito il - 19 maggio 2019 : 18:46:57




|
Io non ho mai corso una reazione di ligazione sul gel. Trasformo sempre tutto.
Proverei un altro ceppo di batteri (non c'è bisogno di comprare, magari chiedi un'aliquota a qualcuno nell'istituto).
E di solito quando non mi viene per nessun motivo, provo dei rapporti a caso, tipo: 10:1 e 1:1. |
Il mio blog: http://domi84.blogspot.com/
Le foto che ho scattato... |
 |
|
|
Gigietto
Nuovo Arrivato

3 Messaggi |
 Inserito il - 21 maggio 2019 : 16:08:21 Inserito il - 21 maggio 2019 : 16:08:21



|
Ciao Grazie domi per la risposta e l'interessamento.
Di solito trasformo anche io senza controllare perchè bene o male mi è sempre andata bene; purtroppo c'è sempre una prima volta.
Ahimè siamo gli unici nel dipartimento a lavorare con batteri e non ho la possibilità di chiedere ad altri. Il plasmide backbone usato nel clonaggio è stato amplificato dallo stesso ceppo di batteri che cerco di trasformare ora.
Ho pensato ad un eventuale calo di efficienza di competenza delle cellule che potrebbe giustificare perchè con i plasmidi superavvolti la trasformazione riesce tranquillamente. A breve tenterò su un nuovo batch di cellule.
Ho tentato anche rapporti 5:1 e 10:1 per vedere se aumentava l'efficienza di ligazione (e quindi l'intensità della banda alta corrispondente al presunto ligato), ma senza grosso successo; non ho ancora trasformato con questi nuovi rapporti, ma visto che non sò cosa altro fare, pensavo di tentare a breve combinando la cosa con il nuovo batch di cellule di cui sopra. Non si sà mai.... |
 |
|
| |
Discussione |
|
|
|
Quanto è utile/interessante questa discussione:
| MolecularLab.it |
© 2003-18 MolecularLab.it |
 |
|
|






