Quanto è utile/interessante questa discussione:
| Autore |
Discussione |
|
|
Limpet
Nuovo Arrivato
Prov.: Roma
Città: Roma

83 Messaggi |
 Inserito il - 06 marzo 2011 : 12:22:51 Inserito il - 06 marzo 2011 : 12:22:51




|
Ormai da tempo faccio riferimento a voi per cercare risposte alle mie domande circa protocolli in tecniche di biologia molecolare e, da quello che leggo, mi sembra ovvio che siamo in molti ad avere dubbi che a lavoro dove non sanno o non vogliono....chiarire. Quindi, grazie sempre.
Devo preparare un loading 6X con glicerolo, Xilene cianolo e BBF.
Ho letto il vostro protocollo sul sito fatto con ficoll al posto del glicerolo e ornage G per i 50bp. Per il resto, posso lasciare tutto uguale? inoltre, continuo a trovare protocolli con concentrazioni tipo:
25% bbf, 25% xylene cianolo FF e 30% glycerol in cui utilizzano solo TE buffer, (dove poi per 10ml pesano 25gr!! invece di 2,5....orrori internettiani)
ma alla fine, come resa quale è la differenza?
grazie per qualunque chiarimento
|
|
|
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 06 marzo 2011 : 12:36:59 Inserito il - 06 marzo 2011 : 12:36:59




|
I loading buffer possono essere fatti piuttosto "a occhio". Il colorante, ad es., serve solo per vedere il fronte, quindi metterne un po' di più o un po' di meno, o metterne uno blu piuttosto che arancione non cambia molto (a parità di PM). Stesso per glicerolo e Ficoll, l'idea è quella di appesantire il campione.
Insomma... modifiche ragionevoli non influenzeranno il risultato. Ovvio però che se metti un kg di blu di bromofenolo a un certo punto questo precipiterà e probabilmente farà danni! |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
Limpet
Nuovo Arrivato
Prov.: Roma
Città: Roma

83 Messaggi |
 Inserito il - 06 marzo 2011 : 12:46:05 Inserito il - 06 marzo 2011 : 12:46:05




|
Certo, hai ragione.
E il buffer a un certo pH è necessario? Leggevo da qualche parte di portare a volume con H2o bidistillata.
grazie, |
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 06 marzo 2011 : 17:26:43 Inserito il - 06 marzo 2011 : 17:26:43





|
Esistono varie ricette di loading dye, in generale si può dire che:
1) coloranti: Xylene Cianolo, Rosso Cresolo, Blu di Bromofenolo, Orange G
servono per "tracciare" la migrazione e ti danno anche un'idea di a che punto del gel sia la tua banda, esistono delle tabelle che mettono in relazione la % del gel con il "peso apparente" in cui migra il colorante, qua ne metto una. Da qui anche la scelta di quali coloranti utilizzare.
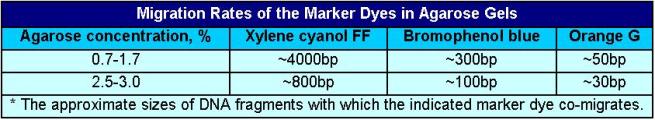
La quantità di colorante non deve essere eccessiva perché ci può essere un effetto di "mascheramento" banda nel caso co-migri con il colorante. In genere il colorante che dà maggiori problemi è il Blu di Bromofenolo (che tra l'altro per la nota legge di Murphy si trova "sempre" a livello della banda di interesse).
25% di XC o di BB corrisponde ad "un quintale"! Non vedresti assolutamente più niente sul gel! Ancora peggio 25gr in 10ml!
Le quantità date dal Maniatis sono 0.25% sia di XC che di BB, quindi sono quelle che troverai riportate più frequentemente. A mio avviso sono comunque "tanto" e rischi il mascheramento della banda. Molto meglio stare molto più bassi e utilizzare formulazioni con 0,03% dei coloranti. Se utilizzi anche l'orange G che ha un'intensità molto inferiore usane 0,15-0,2%. Se vuoi utilizzare il Rosso Cresolo (manca nella tabella, ma migra tra tra XC e BB) va bene una concentrazione di 0,02%. (in genere il rosso cresolo è più utilizzato come colorante direttamente della Mix di PCR perché non interferisce con la TAQ)
2) addensanti: Glicerolo, Saccarosio, Ficoll
servono per addensare il campione e farlo precipitare del pozzetto.
In genere si utilizza:
- 30-60% glicerolo
- 30-40% saccarosio
- 15-25% ficoll
3) buffer:
puoi prepararli benissimo in acqua, ma se utilizzi un buffer è essenzialmente per 2 motivi:
- EDTA: chela gli ioni metallici e quindi inattiva le nucleasi da essi dipendenti (ideale attorno a 50mM)
- pH: simile a quello del gel e del buffer (7,6-8)
Io utilizzo TBE che è lo stesso tampone che uso per far migrare i gel.
 |
 |
|
|
Limpet
Nuovo Arrivato
Prov.: Roma
Città: Roma

83 Messaggi |
 Inserito il - 07 marzo 2011 : 08:58:36 Inserito il - 07 marzo 2011 : 08:58:36




|
Grazie GFPina!
certo 25 gr erano decisamente troppi....ieri sono riuscita a vedere il Maniatis ed effettivamente le concentrazioni sono 0,25% (BBF), 0,25% (Xilene cian), 30% glicerolo. Starò a queste concentrazioni o meno se vedo che non mi trovo. Devo dire che anche io avrei utilizzato il buffer del gel più che il TE,
farò così, allora.
grazie molte!sei stata esaurientissima!spero di poter ricambiare,   |
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
|
|
Andrew81
Nuovo Arrivato

1 Messaggi |
 Inserito il - 07 maggio 2024 : 10:46:05 Inserito il - 07 maggio 2024 : 10:46:05



|
Buongiorno, scusate l'intrusione, mi sono iscritto oggi.
Avrei bisogno di una risposta breve: volevo farmi un po' di LB con il materiale a disposizione... lavoro per una scuola superiore, quindi magari quello che abbiamo, abbiamo... per cui: secondo voi posso usare il blu di bromotimolo al posto di quello di bromofenolo?
Grazie mille |
 |
|
| |
Discussione |
|
|
|
Quanto è utile/interessante questa discussione:
| MolecularLab.it |
© 2003-24 MolecularLab.it |
 |
|
|






