| Autore |
Discussione |
|
|
smsmsm
Nuovo Arrivato

24 Messaggi |
 Inserito il - 27 marzo 2011 : 11:26:15 Inserito il - 27 marzo 2011 : 11:26:15




|
Ciao a tutti…devo verificare la legge di lambert-beer (A=#949; * b* c) con lo spettrofotometro UV-vis della propyl astra blu…ho effettuato l’esperimento in laboratorio e ho ottenuto i tre valori di assorbanza di tre campioni:
1° campione= 1 ml di propyl astra blu + 1 ml di acqua
2° campione= 1,25 ml di propyl astra blu + 0,75 ml di acqua
3° campione= 1,50 ml di propyl astra blu + 0,50 ml di acqua
Valore dell’ assorbanza per il 1° campione è: 0,233215
Per il 2° campione è di 0,104498
Per il 3° campione è di 0,181183.
L’assistente di laboratorio mi ha dato già il valore della concentrazione finale della propyl astra blu che è di 2*10-3 mM, ovvero 0,000002 mol/L, che mi serve per calcolare #949;=Assorbanza/concentrazione.
Devo in pratica verificare la linearità della legge costruendo il grafico assorbanza in funzione della concentrazione. Facendo così però non ottengo una retta passante per l’origine ma una retta parallela all’ asse delle ordinate, ossia dell’ assorbanza… secondo voi è normale??? Secondo me no perché dovrei avere tre valori di concentrazione diverse per ottenere una retta passante per l’origine!!! Cosa devo fare? Devo calcolarmi qualcosa???

|
|
|
|
|
Ale_90
Utente Junior


296 Messaggi |
 Inserito il - 27 marzo 2011 : 11:36:15 Inserito il - 27 marzo 2011 : 11:36:15




|
| Prova a rifare il primo campione, secondo me è tutto li il problema. E per le mie reminescenze di perito chimico, prova a fare ancora un quarto campione, 1,75 + 0,25; così per sfizio. Tanto non è preparare un campione in più o in meno che ti ruba tempo/soldi all'università... |
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 27 marzo 2011 : 11:39:12 Inserito il - 27 marzo 2011 : 11:39:12




|
Citazione:
Devo in pratica verificare la linearità della legge costruendo il grafico assorbanza in funzione della concentrazione. Facendo così però non ottengo una retta passante per l’origine ma una retta parallela all’ asse delle ordinate, ossia dell’ assorbanza… secondo voi è normale???
No... ma non capisco come ti faccia a venire una retta orizzontale, il terzo punto è molto più alto dei primi 2primo punto è molto più alto degli altri due...
Piuttosto è il primo punto quello che non funziona. Hai preso la lettura più volte? |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
smsmsm
Nuovo Arrivato

24 Messaggi |
 Inserito il - 27 marzo 2011 : 15:59:37 Inserito il - 27 marzo 2011 : 15:59:37




|
Purtroppo non posso rifare altre analisi...ma non credo che sia questo il problema cioè il fatto che io abbia tre campioni o quattro. Mi esce una retta verticale nel grafico perchè se ho a disposizione un solo valore di concentrazione sull' asse delle x relativo alla concentrazione, non potrei mai ottenere una retta in obliquo. L'assistente mi ha ddetto che quella è la concentrazione per ricavarti la epsilon...  |
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 27 marzo 2011 : 16:40:53 Inserito il - 27 marzo 2011 : 16:40:53




|
Scusami... avevo letto male i dati prima. Ad ogni modo lasciamo un attimo perdere il valore di concentrazione del composto puro, chiamiamolo C.
I tuoi 3 campioni hanno concentrazione:
0.5*C, 0.625*C e 0.75*C
Quindi facendo un grafico di [] vs assorbanza ottieni (con i valori di assorbanza che hai riportato)
Immagine:
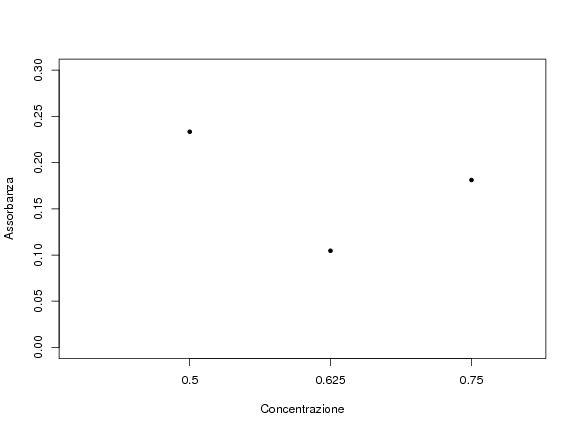
10,5 KB
La sola considerazione che si può fare è che la prima lettura fosse sballata per qualche motivo |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
chim2
Utente Attivo
  


2110 Messaggi |
 Inserito il - 27 marzo 2011 : 17:22:54 Inserito il - 27 marzo 2011 : 17:22:54




|
non conosco questa soluzione potrei avere qualche informazione su di essa?
Perchè non hai il valore del bianco?Per tarare si fanno soluzioni di standard crescenti e poi si prelevano le aliquote poi alla fine si trova la concentrazione,cioè l'H20 immagino serva solo a portare a volume in matracci però la concentrazione degli standard portati a volume cambia,come l'hai calcolata?
Qual è la concentrazione della soluzione standard? |
 |
|
|
smsmsm
Nuovo Arrivato

24 Messaggi |
 Inserito il - 27 marzo 2011 : 18:06:46 Inserito il - 27 marzo 2011 : 18:06:46




|
| Scusa ma vorrei capire come hai ottenuto quel grafico e cosa sono quei valori che hai messo sull'asse delle x...quando ho fatto la prova in laboratorio, l'assistente mi ha consigliato di fare i campioni con quei volumi perchè ci si sarebbe aspettati la linearità...per spiegarmi in precedenza ho fatto un' altra analisi miscelando etanolo e curcumina e in quel caso non ho avuto problemi in quanto dal rapporto massa in grammi della curcumina/PM curcumina mi sono ricavata il numero di moli che ho diviso poi per il volume di ciascun campione ottenendo la concentrazione finale. Quindi avendo 4 campioni e quattro concentrazioni diverse ho costruito il grafico assorbanza/concentrazione. In quest' altra analisi con la propyl astra blu, mi è stata già data la concentrazione e quindi non ho eseguito altri calcoli...non saprei cosa fare anche perchè non posso dire all' assistente "mi sa che hai sbagliato". Ecco perchè mi sono rivolta a voi. Comunque mi interesserebbe capire capire il grafico che mi hai individuato. Ciao |
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 27 marzo 2011 : 18:45:56 Inserito il - 27 marzo 2011 : 18:45:56




|
Diciamo che il tuo colorante fosse stato 1mg/ml... se prendi 1 ml di propyl astra blu + 1 ml di acqua la concentrazione finale sarà 0.5 mg/ml, se prendi 1,25 ml di propyl astra blu + 0,75 ml di acqua avrai 0.625 mg/ml e se prendi 1,50 ml di propyl astra blu + 0,50 ml di acqua avrai 0.75 mg/ml.
Ovviamente se la concentrazione iniziale fosse 5 mg/ml le soluzioni finali sarebbero 5 volte più alte e così via.
Misurando l'assorbanza di campioni via via più concentrati questa sarà via via più alta, secondo la legge di LB. Ti torna adesso? |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
chim2
Utente Attivo
  


2110 Messaggi |
|
|
smsmsm
Nuovo Arrivato

24 Messaggi |
 Inserito il - 28 marzo 2011 : 17:26:03 Inserito il - 28 marzo 2011 : 17:26:03




|
Non so la concentrazione della prpyl astra blu, conosco solo quella per calcolare la epsilon e cioè 2*10-3 mM.
|
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 28 marzo 2011 : 17:34:56 Inserito il - 28 marzo 2011 : 17:34:56





|
Citazione:
Messaggio inserito da chim2
ma io non mi trovo,cioè se non si sa che concentrazione ha la propyl astra blu come si fa a stabile la concentrazione dopo l'aggiunta di H20?
Ma veramente chick80 ha semplicemente messo in grafico i punti per far vedere che "comunque" c'è qualcosa di strano nel primo punto.
Il senso è questo: qualunque sia la concentrazione iniziale della soluzione da cui parti tu fai delle diluizioni da quella, quindi:
Citazione:
1° campione= 1 ml di propyl astra blu + 1 ml di acqua
2° campione= 1,25 ml di propyl astra blu + 0,75 ml di acqua
3° campione= 1,50 ml di propyl astra blu + 0,50 ml di acqua
sono 3 diluizioni: 1:2, 1,25:2 e 1,50:2
la prima sarà quindi 1/2 (4/8) della concentrazione iniziale, la seconda sarà 5/8 di quella iniziale e la terza 6/8, quindi come diceva chick, puoi considerare come una costante (C) il valore di concentrazione iniziale e indicare le concentrazioni dei 3 campioni rispetto a questa:
Citazione:
Ad ogni modo lasciamo un attimo perdere il valore di concentrazione del composto puro, chiamiamolo C.
I tuoi 3 campioni hanno concentrazione:
0.5*C, 0.625*C e 0.75*C
In ogni caso quello che non torna è il fatto che l'assorbanza del primo punto (concentrazione inferiore delle 3 saggiate) sia così alta!
Comunque sia:
Citazione:
Riformulo la domanda che concentrazione ha la soluzione standard di propyl astra blu?
credo sia questa indicata nel primo post:
Citazione:
L’assistente di laboratorio mi ha dato già il valore della concentrazione finale della propyl astra blu che è di 2*10-3 mM, ovvero 0,000002 mol/L,
|
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 28 marzo 2011 : 17:38:46 Inserito il - 28 marzo 2011 : 17:38:46





|
Citazione:
Messaggio inserito da smsmsm
Non so la concentrazione della prpyl astra blu, conosco solo quella per calcolare la epsilon e cioè 2*10-3 mM.
Scusa visto che hai risposto mentre stavo postando per rispondere a chim2, tu dici che hai questa concentrazione per calcolare epsilon, ma dovresti avere anche un valore si assorbanza relativo a questa concentrazione, altrimenti come calcoli epsilon? |
 |
|
|
chim2
Utente Attivo
  


2110 Messaggi |
 Inserito il - 28 marzo 2011 : 18:00:08 Inserito il - 28 marzo 2011 : 18:00:08




|
Citazione:
Messaggio inserito da GFPina
Citazione:
Messaggio inserito da chim2
ma io non mi trovo,cioè se non si sa che concentrazione ha la propyl astra blu come si fa a stabile la concentrazione dopo l'aggiunta di H20?
Ma veramente chick80 ha semplicemente messo in grafico i punti per far vedere che "comunque" c'è qualcosa di strano nel primo punto.
Il senso è questo: qualunque sia la concentrazione iniziale della soluzione da cui parti tu fai delle diluizioni da quella, quindi:
[quote]1° campione= 1 ml di propyl astra blu + 1 ml di acqua
2° campione= 1,25 ml di propyl astra blu + 0,75 ml di acqua
3° campione= 1,50 ml di propyl astra blu + 0,50 ml di acqua
sono 3 diluizioni: 1:2, 1,25:2 e 1,50:2
[quote]
si ho capito cosa voleva dire chick80 sui rapporti ma io mi riferivo al ragazzo:o si è dimenticato di segnare la concentrazione dello standard o è stata una mancanza dei tecnici che non l'hanno riferito...detto questo la cosa che mi è subito saltato all'occhio è che non vedo il bianco...
cmq come riportato in quei link a me davano la soluzione a molarità nota da quella ne preparavo 5 a molarità crescente quindi prelevavo mettevo in un matraccino e portavo a volume poi successivamente prelevo (è questa la concentrazione che misuro),mi faccio la retta e poi trovo la concetrazione nel campione incognito...
per quanto rigurarda il 1 punto un pò strano può dipendere dal titolo non calcolato bene (non saprei se l'hanno già comprata o preparata,magari non hanno standardizzato e ovvio che non viene nessuna misura analitica),oppure può dipendere direttamente dai ragazzi quando hanno portato a volume :errore di parallasse e via dicendo per questo il 1 punto corrispondente alla 1 soluzione è "sballato"...
(però penso che abbiamo sbagliato la 1 soluzione diluita) |
 |
|
|
chim2
Utente Attivo
  


2110 Messaggi |
 Inserito il - 28 marzo 2011 : 18:08:15 Inserito il - 28 marzo 2011 : 18:08:15




|
Citazione:
Messaggio inserito da GFPina
Citazione:
Comunque sia:
Citazione:
Riformulo la domanda che concentrazione ha la soluzione standard di propyl astra blu?
credo sia questa indicata nel primo post:
[quote]L’assistente di laboratorio mi ha dato già il valore della concentrazione finale della propyl astra blu che è di 2*10-3 mM, ovvero 0,000002 mol/L,
ah ok io avevo inteso quella del campione incognito ,cioè gli ha detto il valore vero cosi' potevano controllare dopo le misure booo |
 |
|
|
smsmsm
Nuovo Arrivato

24 Messaggi |
 Inserito il - 28 marzo 2011 : 18:19:57 Inserito il - 28 marzo 2011 : 18:19:57




|
Prima di effettuare l' analisi ho fatto il bianco con acqua e poi dopo ho fatto l'analisi dei vari campioni...l'altro dato che mi è stato dato è il peso molecolare della propyl astra blu...ma non credo che mi servi a qualcosa... |
 |
|
|
smsmsm
Nuovo Arrivato

24 Messaggi |
 Inserito il - 28 marzo 2011 : 19:50:29 Inserito il - 28 marzo 2011 : 19:50:29




|
rispondo a GFPina:
i valori di assorbanza ce li ho per ogni campione; è la concentrazione che mi dà problemi perchè dovrei evere una per ogni campione in modo che posso ottenere una retta obliqua...mi sa che non ci sono soluzioni!!! |
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 28 marzo 2011 : 20:25:00 Inserito il - 28 marzo 2011 : 20:25:00




|
Citazione:
i valori di assorbanza ce li ho per ogni campione; è la concentrazione che mi dà problemi perchè dovrei evere una per ogni campione
Ma ce l'hai la concentrazione per ogni campione!!!
Se hai sempre diluito la stessa soluzione di partenza aggiungendo diverse quantità d'acqua la concentrazione la trovi come ti abbiamo scritto sopra.
Consiglio di leggerti queste pagine: http://www.molecularlab.it/principi/calcoli-laboratorio/ |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
smsmsm
Nuovo Arrivato

24 Messaggi |
 Inserito il - 02 aprile 2011 : 12:26:39 Inserito il - 02 aprile 2011 : 12:26:39




|
| mi sembra di aver detto che ho una sola concentrazione uguale per i tre campioni e tre valori di assorbanza...e non di avere tre cncentrazioni! |
 |
|
|
chim2
Utente Attivo
  


2110 Messaggi |
 Inserito il - 02 aprile 2011 : 13:13:39 Inserito il - 02 aprile 2011 : 13:13:39




|
smsmsm il procedimento è tutto scritto nei file che ti ho linkato (anche se non ho ancora capito la concentrazione dello standard iniziale!!!)poi calcoli le concentrazioni come ti ha detto chick,l'equazione della retta la ricavi da excelle se non la vuoi fare tu ,dopo che hai ottenuto l'equazione della retta ricavi la concentrazione nel campione incognito...però come ti abbiamo fatto notare il 1 punto non è lineare quindi hai commesso degli errori nella diluizione a cui non si può porre rimedio almeno che non lo rifai.....cmq non ho mai visto fare un retta con soli 3 punti,statisticamente almeno 5,vedi che ti dice il tuo prof  |
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 02 aprile 2011 : 13:38:19 Inserito il - 02 aprile 2011 : 13:38:19





|
Citazione:
Messaggio inserito da smsmsm
mi sembra di aver detto che ho una sola concentrazione uguale per i tre campioni e tre valori di assorbanza...e non di avere tre cncentrazioni!
Se parti da una concentrazione e fai una diluizione hai un'altra concentrazione!!!
Se da una stessa soluzione fai 3 diluizioni avrai 3 concentrazioni!!! |
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 02 aprile 2011 : 14:09:19 Inserito il - 02 aprile 2011 : 14:09:19




|
Prendi un bicchiere e riempilo per 1/3 di vino rosso e guardane il colore.
Adesso aggiungi acqua fino a riempirlo. E' diventato più chiaro?
Questo è l'equivalente casalingo dell'esperimento che hai fatto in lab. Come ti ha giustamente detto GFPina hai 3 concentrazioni diverse, perchè hai miscelato acqua e campione in diversi rapporti. |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
smsmsm
Nuovo Arrivato

24 Messaggi |
 Inserito il - 03 aprile 2011 : 11:24:22 Inserito il - 03 aprile 2011 : 11:24:22




|
rispondo a chim2:
lo so ma ho solo tre punti per colpa dell' assistente di laboratorio che ha detto che bastavano tre...comincio a dubitare sulla preparazione di quella persona. Inoltre mi hai scritto che non hai capito la concentrazione iniziale...è normale è proprio quella che non ho e che non mi ha dato ma solo quella finale...comunque riguarderò tutto e vedrò che posso fare!!! |
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 03 aprile 2011 : 13:18:34 Inserito il - 03 aprile 2011 : 13:18:34





|
Io non dubiterei della preparazione dell'assistente, ma piuttosto andrei a ristudiarmi un po' la teoria!!!
Abbiamo cercato (invano) in 3 di farti capire la cosa!
La concentrazione che ti ha dato all'inizio l'assistente è verosimilmente la concentrazione iniziale, non quella finale e da lì hai fatto 3 diluizioni, di cui calcolarsi la concentrazione è veramente banale!
Comunque se anche fosse stata la concentrazione finale (cosa di cui dubito fortemente), quindi la concentrazione della soluzione più diluita (la terza), non dovresti far altro che fare il procedimento inverso (divisione al posto di moltiplicazione) per calcolarti le altre concentrazioni.
Evidentemente come abbiamo cercato di spiegarti è successo qualcosa "sperimentalmente" durante l'esercitazione per cui una delle diluizioni è stata preparata nel modo sbagliato, per questo motivo hai un valore sballato! |
 |
|
|
smsmsm
Nuovo Arrivato

24 Messaggi |
 Inserito il - 04 aprile 2011 : 11:19:14 Inserito il - 04 aprile 2011 : 11:19:14




|
Grazie per il consiglio GF Pina!!! Lo sai che io ho sempre fatto la teoria prima della pratica??? questa volta avevo proprio ragione che era l' assistente che si è sbagliato e ch quella non era la concentrazione finale!!! come io avevo sempre sospettato!!! Sai anche chi sta più avanti rspetto ad una laureanda può sbagliare! Fa parte della natura sbagliare! Ciao e scusate se vi ho fatto perdere tempo su una questione che poteva in realtà non esserci! a tutti!!! a tutti!!! |
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 04 aprile 2011 : 17:09:43 Inserito il - 04 aprile 2011 : 17:09:43





|
Infatti io l'ho detto fin dall'inizi che mi sembrava più plausibile fosse la concentrazione iniziale e non quella finale.
Tutti possono sbagliare, è ovvio, ma dire che si dubita della preparazione di una docente mi sembra un'affermazione abbastanza pesante! |
 |
|
|
smsmsm
Nuovo Arrivato

24 Messaggi |
 Inserito il - 05 aprile 2011 : 17:38:47 Inserito il - 05 aprile 2011 : 17:38:47




|
| Confermo che il risultato è il grafico di chick80 quindi non verifica la legge e qualcosa deve essere andato male nell' analisi...pazienza!!! |
 |
|
| |
Discussione |
|







