| Autore |
Discussione |
|
|
darwin dude
Nuovo Arrivato

7 Messaggi |
 Inserito il - 09 novembre 2011 : 17:39:11 Inserito il - 09 novembre 2011 : 17:39:11




|
Ciao Ragazzi, ho un problemino nell'assegnazione delle bande di questo campione di DNA non linearizzato
il plasmide e' pHV14 7296bp
il ladder e' generuler 1kb
Immagine:

524,55 KB
a livello della 9 banda (3500bp) del ladder immagino ci sia il superavvolto
a livello della 12 (6000bp) c'e una banda che forse e' da assegnare al convalently closed
a livello della 14 (e ultima)banda (10000bp) c'e una banda debole che non so assegnare
oltre c'e una banda piu intensa dovuta al nicked
a pesi molecolari ancora maggiori ce ne sono altre che sono multimeri
non so quanto posso averci dato. mi sapreste dare una mano
grazie mille!!
|
|
|
|
|
roberta.s
Utente Junior


Città: Parigi

564 Messaggi |
 Inserito il - 09 novembre 2011 : 17:51:45 Inserito il - 09 novembre 2011 : 17:51:45




|
Normalmente un plasmide circolare si presenta su gel in 3 forme: supercoiled, nicked e multimer.
A mio avviso, l'interpretazione della corsa elettroforetica di plasmidi circolari, soprattutto se ad alto peso molecolare, è spesso difficile. Hai provato a linearizzare il tuo plasmide per accertarti che sia corretto?
Acosa ti serve l'analisi del plasmide circolare? |
 |
|
|
darwin dude
Nuovo Arrivato

7 Messaggi |
 Inserito il - 11 novembre 2011 : 11:40:57 Inserito il - 11 novembre 2011 : 11:40:57




|
Ciao roberta.s, grazie per la risposta.
Si, ho linearizzato il plasmide, (ti allego la foto, 1a lane).
Effettivamente, le informazioni piu` importanti le abbiamo dall'analisi del gel del campione linearizzato.
In particolare, il plasmide e` stato sottoposto a irraggiamento. dal confronto: lineare irraggiato-controllo e` evidente la presenza di danno.
Detto questo pero` l'analisi del circolare potrebbe darmi ulteriori informazioni.
Ossia:
se nel circolare irraggiato vedo comparire una banda intensa a 7296bp (banda del linearizzato) e` chiaro che c'e` stato almeno un Double Strand Break.
se nel circolare irraggiato vedo comparire una banda intensa a livello del nicked e` chiaro che c'e` stato almeno un Single Strand Break.
contemporaneamente se nel circolare irraggiato l'intensita` della banda del supercoiled diminuisce e` una conferma del DSB e SSB.
inoltre sempre nel circolare irraggiato vedo comparire una smear dovuta a rotture multiple del plasmide.
spero di essere stato chiaro.
grazie ancora per eventuali delucidazioni e opinioni
Immagine:
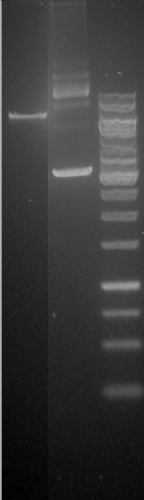
60,26 KB |
 |
|
|
roberta.s
Utente Junior


Città: Parigi

564 Messaggi |
 Inserito il - 11 novembre 2011 : 19:35:35 Inserito il - 11 novembre 2011 : 19:35:35




|
Se ho capito bene, nella seconda foto che mostri c'è il lineare (a sx) e il circolare sottoposto ad irraggiamento (a dx). Io aggiungerei un altro controllo che, in questo caso, sarebbe il circolare non irraggiato, cosi' da poter fare un confronto. Non sono pratica di questa tecnica, quindi l'unica osservazione che posso fare è che nel circolare non vedo nessuna banda equivalente a quella del plasmide lineare, per cui escluderei una rottura dello scheletro del plasmide. Forse guardando meglio si vede una banda poco intensa, ma dovresti aumentare il contrasto nella foto.
|
 |
|
|
darwin dude
Nuovo Arrivato

7 Messaggi |
 Inserito il - 14 novembre 2011 : 16:37:17 Inserito il - 14 novembre 2011 : 16:37:17




|
scusa roberta.s l'immagine che ti ho allegato non contiene il campione irraggiato. avevo scritto cosa mi attendevo solo per farti capire gli obiettivi del lavoro ma era effettivamente incomprensibile e inimmaginabile a cosa alludevo.
in questo che segue c'e` a sx il linearizzato, due campioni irraggiati, il controllo non irraggiato, il ladder. quanto detto prima vale comunque
si chiaramente nel controllo la banda del lineare nn c'e`...il problema sono le altre
Immagine:

260,14 KB |
 |
|
|
darwin dude
Nuovo Arrivato

7 Messaggi |
 Inserito il - 18 novembre 2011 : 11:58:54 Inserito il - 18 novembre 2011 : 11:58:54




|
nessuna idea?! buttatevi pure, ogni discussione e` ben accetta. sono consapevole che l'analisi del plasmidico sia difficile e anche un po` aleatoria. non a caso non ne sono ancora venuto a capo!
grazie!!! |
 |
|
|
roberta.s
Utente Junior


Città: Parigi

564 Messaggi |
 Inserito il - 18 novembre 2011 : 15:06:15 Inserito il - 18 novembre 2011 : 15:06:15




|
| Darwin, io davvero credo di non aver focalizzato la domanda |
 |
|
|
darwin dude
Nuovo Arrivato

7 Messaggi |
 Inserito il - 21 novembre 2011 : 18:58:37 Inserito il - 21 novembre 2011 : 18:58:37




|
ok roberta.s riproviamoci
guara l'ultima immagine che ho allegato. ci sono 5 pozzetti caricati
1 dna plasmidico linearizzato non irraggiato
2 e 3 dna plasmidico non linearizzato e sottoposto a irraggiamento
4 dna plasmidico non linearizzato e non sottoposto a irraggiamento(controllo)
5 ladder
domanda:attribuzione bande campione 4
grazie |
 |
|
| |
Discussione |
|







