| Autore |
Discussione |
|
|
zauro81
Nuovo Arrivato

30 Messaggi |
 Inserito il - 11 maggio 2010 : 16:08:31 Inserito il - 11 maggio 2010 : 16:08:31




|
Salve ragazzi, non so se scrivo nella sezione giusta, quindi perdonatemi se ho sbagliato!!
Vengo subito al dunque, la domanda è semplice (un pò meno la risposta), non capisco il meccanismo di reazione di questa reazione:
1,4-diterzbutilbenzene + acido nitrico--> 2-metilpropene + 1-nitro-4-terzbutilbenzene
Avete qualche idea??
Il mio prof. di organica si diverte a farci impazzire!!!!
Grazie a tutti cmq
Ciao
|
|
|
|
|
chim2
Utente Attivo
  


2110 Messaggi |
 Inserito il - 11 maggio 2010 : 16:40:20 Inserito il - 11 maggio 2010 : 16:40:20




|
intanto senza H2SO4 non avviene nulla,si deve formare l'NO2+!il gruppo alchilico viene espulso come carbocatione,in più non hai solo un prodotto ma ce l' hai anche in meta il nitro,quindi hai 2 prodotti  |
 |
|
|
zauro81
Nuovo Arrivato

30 Messaggi |
 Inserito il - 11 maggio 2010 : 16:46:45 Inserito il - 11 maggio 2010 : 16:46:45




|
Ciao chim2, grazie per la risposta, dimenticavo di dire che la reazione non me la sono inventata io, ma fa parte di un compito scritto di chimica organica del corso di laurea in CTF. Nel quesito non c'è scritto acido solforico ma acido nitrico, per il resto la reazione è scritta così come l'ho riportata (avrei voluto anch'io che ci fosse stato scritto H2SO4!!). Di prodotti se ne formano due, e sono quelli da me riportati.
grazie cmq per l'interessamento
Ciao |
 |
|
|
chim2
Utente Attivo
  


2110 Messaggi |
 Inserito il - 11 maggio 2010 : 16:50:02 Inserito il - 11 maggio 2010 : 16:50:02




|
scusa volevo dire il 3 prodotto ..nono hai pure il NO2 in meta con entrambi i gruppi alchilici,per il resto ti vuole solo far notare la sostituzione con NO2+ e la formazione del carbocatione,soggetta ad aventuali trasposizioni..
se non c'è H2SO4 è stato un errore del prof,la miscela solfo-nitrica è solitamente indispensabile per nitrare in questo caso  |
 |
|
|
zauro81
Nuovo Arrivato

30 Messaggi |
 Inserito il - 11 maggio 2010 : 16:54:33 Inserito il - 11 maggio 2010 : 16:54:33




|
OK, il prodotto in meta con i due gruppi alchilici sarebbe il terzo prodotto. Quello che non capisco è come si forma , anche ammettendo la presenza dell'acido solforico, L'1-nitro-4 terzbutil-benzene???
Scusa se insisto, ma non capisco cosa vuoi dire...prova a scrivere il prodotto e guarda il reagente.
Ciao |
 |
|
|
chim2
Utente Attivo
  


2110 Messaggi |
 Inserito il - 11 maggio 2010 : 17:03:15 Inserito il - 11 maggio 2010 : 17:03:15




|
quando attacca l'NO2 esce il carbocatione terz-butile,vedendo il prodotto questo poi elimina un H+ del resto c'è una base forte 
scusa non avviene nessuna trasposizione hai un carbocatione stabile  |
 |
|
|
zauro81
Nuovo Arrivato

30 Messaggi |
 Inserito il - 11 maggio 2010 : 17:11:34 Inserito il - 11 maggio 2010 : 17:11:34




|
quindi lo ione nitronio attacca in posizione 1, cioè la posizione occupata dal gruppo terzbutilico, giusto?
La base forte quale sarebbe??l'acqua??In caso affermativo l'idrogeno che stacca è quello del gruppo terzbutilico??
Grazie per l'infinita pazienza che hai
|
 |
|
|
chim2
Utente Attivo
  


2110 Messaggi |
 Inserito il - 11 maggio 2010 : 17:21:27 Inserito il - 11 maggio 2010 : 17:21:27




|
hai basi in questo caso se vedi gli equilibri tra acido solforico e nitrico:
NO3- HSO4-
certo che si stacca quell'H  |
 |
|
|
zauro81
Nuovo Arrivato

30 Messaggi |
 Inserito il - 11 maggio 2010 : 18:24:02 Inserito il - 11 maggio 2010 : 18:24:02




|
Immagine:
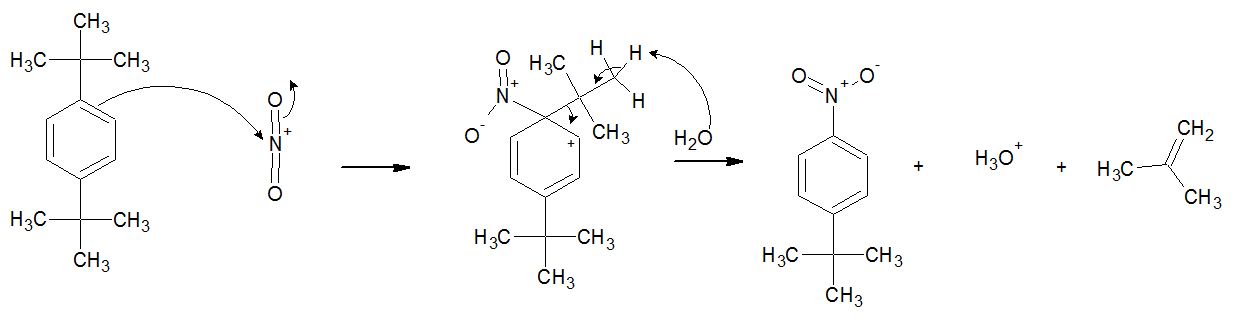
39,38 KB
Per chiarire definitivamente, il meccanismo è questo??
Ovviamente al posto dell'acqua possiamo usare una qualunque base presente nell'ambiente di reazione, come NO3- ad esempio, che ovviamente non è una base forte, così come l'acqua, la quale si genera dall'autoprotonazione dell'acido nitrico!!!
NON CI SONO BASI FORTI IN SOLUZIONE!
Non è necessaria la presenza dell'acido solforico!!Basta usare acido nitrico a caldo, si ottiene lo stesso risultato!!
Immagine:
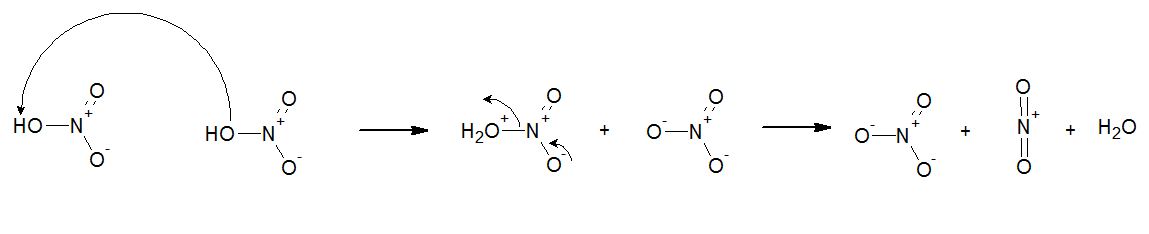
25,1 KB
Grazie mille!! |
 |
|
|
chim2
Utente Attivo
  


2110 Messaggi |
 Inserito il - 11 maggio 2010 : 18:42:08 Inserito il - 11 maggio 2010 : 18:42:08




|
base debole e base forte è sempre relativo!
si mi sembra plausibile |
 |
|
|
zauro81
Nuovo Arrivato

30 Messaggi |
 Inserito il - 11 maggio 2010 : 18:45:41 Inserito il - 11 maggio 2010 : 18:45:41




|
Certo, ma se in soluzione c'è acido nitrico che base forte vorresti trovare in soluzione???
Si neutralizzerebbe all'istante!!!
Che dici??
Grazie cmq per i consigli |
 |
|
|
chim2
Utente Attivo
  


2110 Messaggi |
 Inserito il - 11 maggio 2010 : 18:52:11 Inserito il - 11 maggio 2010 : 18:52:11




|
| l'acido nitrico l'ho sempre visto protonato dal solforico |
 |
|
| |
Discussione |
|






