Quanto è utile/interessante questa discussione:
| Autore |
Discussione |
|
|
memole
Utente Junior


Prov.: Brindisi
Città: brindisi

577 Messaggi |
 Inserito il - 04 gennaio 2008 : 18:41:30 Inserito il - 04 gennaio 2008 : 18:41:30




|
| Se posso dire la mia credo che per certi esami sia NECESSARIO spendere, se così vogliamo dire, del tempo. Io personalmente ci ho messo quasi 3 mesi a preparare chimica organica (studio a Lecce e l'esame era col prof Troisi, chi lo ha conosciuto di certo mi capirà), ma ammetto di essermi fissata abbastanza perchè ero terrorizzata dal prof. Al di là di questo, per quanto uno possa essere veloce nell'apprendere, ci vuole del tempo per metabolizzare e fare propria una materia come la chimica organica, la biochimica o la fisiologia. Studiare tutto il programma in pochi giorni significa imbottirsi il cervello di nozioni che poi vengono rimosse al tour de force successivo. |
 |
|
|
Ultimo
Utente Junior


Prov.: Lecce
Città: Alezio

290 Messaggi |
 Inserito il - 05 gennaio 2008 : 18:34:42 Inserito il - 05 gennaio 2008 : 18:34:42





|
| sapete dove posso trovare un meccanismo dettagliato dell'idrolisi in generale di esteri e l'idrolisi di enammine? E poi basta con questa polemica,che stiamo facendo a chi è bravo,più bello e più intelligente??Potrei anche io scrivere il programma di chimica organica che è tre volte qllo scritto sopra ma vorrei che questa discussione fosse UTILE e non una semplice CHIACCHIERATA senza alcun fine positivo. |
 |
|
|
Dionysos
Moderatore
  

Città: Heidelberg

1913 Messaggi |
 Inserito il - 05 gennaio 2008 : 19:54:11 Inserito il - 05 gennaio 2008 : 19:54:11





|
Se si tratta solo di esteri, posso aiutarti:
Immagine:
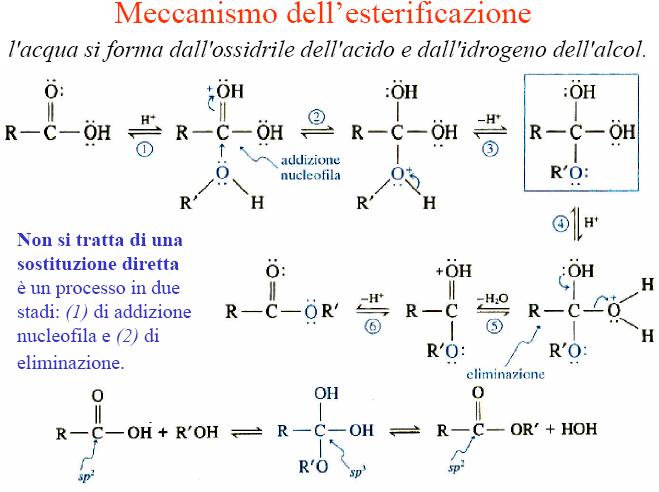
50,76 KB |
Volere libera : questa é la vera dottrina della volontà e della libertà
(F.W. Nietzsche)
Less Jim Morrison, more Sean Morrison!
|
 |
|
|
Dionysos
Moderatore
  

Città: Heidelberg

1913 Messaggi |
 Inserito il - 05 gennaio 2008 : 19:55:50 Inserito il - 05 gennaio 2008 : 19:55:50





|
Per l'idrolisi dell'estere, basta che percorri la reazione al contrario  |
Volere libera : questa é la vera dottrina della volontà e della libertà
(F.W. Nietzsche)
Less Jim Morrison, more Sean Morrison!
|
 |
|
|
Patrizio
Moderatore
  

Città: Barcellona

1915 Messaggi |
 Inserito il - 05 gennaio 2008 : 21:26:09 Inserito il - 05 gennaio 2008 : 21:26:09





|
Citazione:
Messaggio inserito da Ultimo
sapete dove posso trovare un meccanismo dettagliato dell'idrolisi in generale di esteri e l'idrolisi di enammine? E poi basta con questa polemica,che stiamo facendo a chi è bravo,più bello e più intelligente??Potrei anche io scrivere il programma di chimica organica che è tre volte qllo scritto sopra ma vorrei che questa discussione fosse UTILE e non una semplice CHIACCHIERATA senza alcun fine positivo.
Ultimo tra le cose che a te non interessava leggere c'era anche quacosa ache avresti dovuto leggere e avresti trovato la risposta all idrolisi delle ammine,e ti ho anche postato il link...io non ho bisogno di dimostrare che sono bravo perche' lo sono e basta ,la risposta non era rivolta a te ma ad un altro.... e cmq sono contento per il tuo programma,bravo,sarai un ottimo chimico organico |

|
 |
|
|
Patrizio
Moderatore
  

Città: Barcellona

1915 Messaggi |
 Inserito il - 05 gennaio 2008 : 21:37:09 Inserito il - 05 gennaio 2008 : 21:37:09





|
Legame covalente e polare e forma delle molecole organiche: Richiami sul legame chimico. Strutture di Lewis e calcolo della carica formale. Risonanza. Ibridazioni sp3, sp2 e sp del carbonio. Classificazione dei composti organici e panoramica dei loro gruppi funzionali (priorità relative nella nomenclatura).
Alcani e Cicloalcani: Struttura, nomenclatura IUPAC e tradizionale. Proprietà chimico-fisiche. Isomeria costituzionale negli alcani ed isomeria geometrica nei cicloalcani (requisiti). Differenza tra configurazioni e conformazioni. Conformazioni di alcani (etano, propano e butano): proiezioni di Newman (sfalsate, eclissate), a cunei e a cavalletto; diagrammi di energia potenziale. Cicloalcani: tensioni torsionali ed angolari per ciclopropano, ciclobutano, ciclopentano ed equilibri conformazionali in cicloesani mono-, di- e polisostituiti. Composti biciclici condensati, a ponte e spiro: struttura e nomenclatura.
Nomenclatura IUPAC e tradizionale e proprietà chimico fisiche di: alogenuri alchilici, alcoli, tioli, eteri, solfuri, ammine, derivati carbonilici (aldeidi e chetoni), acidi carbossilici e loro derivati (alogenuri acilici, anidridi, esteri, ammidi, nitrili), derivati stabili dell’acido carbonico (uree, carbonati, carbammati).
Composti Aromatici ed Eteroaromatici: Concetto di aromaticità, antiaromaticità, energia di risonanza. Ioni aromatici ed antiaromatici. Nomenclatura di benzeni mono-, di- e polisostituiti e dei principali composti eteroaromatici.
Chiralità e Stereoisomeria: Introduzione alla chiralità nella 1a, 2a e 3a dimensione. Chiralità e Stereogenicità: principi generali. Elementi di simmetria (centro, piano e assi semplici di simmetria) e loro compatibilità con la chiralità. Molecole dissimmetriche ed asimmetriche. Enantiomeri e diastereoisomeri. Proiezioni di Fischer. Configurazioni relative (sistema D,L) ed assolute (sistema R,S e regole di priorità). Polarimetro ed attività ottica. Purezza ed eccesso enantiomerico. Risoluzione ottica di miscele racemiche. Stereoisomeria nei sistemi aciclici con due o più stereocentri: forme treo, eritro, meso e carboni “pseudoasimmetrici”. Stereoisomeria nei sistemi ciclici. Enantiomeria e diastereoisomeria conformazionale nei cicloesani disostituiti. Isomeria geometrica negli alcheni (requisiti e nomenclatura E,Z). Attività ottica: requisiti. Molecole chirali in assenza di stereocentri: caso degli alleni chirali. Carboni prochirali, idrogeni enantiotopici e diastereotopici.
Acidità e Basicità in Chimica Organica: Generalità. Fattori strutturali ed elettronici che influenzano l’acidità e la basicità dei composti organici: elettronegatività, energia di legame, ibridazione, effetti induttivi (±I), effetti coniugativi (±M). Basicità di alcoli, di alchil- ed arilammine in fase gassosa e in soluzione: relazione tra DG° e pKa. Predizione della direzione degli equilibri in base ai valori di pKa.
Introduzione ai meccanismi di reazione: Richiami di termodinamica: reazioni eso- e endoergoniche, eso- e endotermiche, relazione tra energia libera standard e costante di equilibrio. Richiami di cinetica: energia libera di attivazione, velocità, ordine e molecolarità di reazione, stadio limitante la velocità di reazione, postulato di Hammond, stato di transizione e complesso attivato, intermedi di reazione.
Addizioni Elettrofile: Alcheni: struttura e reattività. Addizioni elettrofile ad alcheni (addizione ioniche di acidi alogenidrici: regioselettività, regola di Markovnikov, stabilità di carbocationi e loro trasposizioni; addizione di acqua ed alcoli; addizione di alogeni: regio- e steroselettività; formazioni di aloidrine; significato di addizioni sin e anti). Idroborazione-ossidazione di alcheni (regio- e steroselettività). Alchini: struttura, polarizzabilità e acidità di alchini terminali. Addizioni elettrofile ad alchini: generalità (confronto tra carbocationi alchilici e vinilici); addizione di acidi alogenidrici ed alogeni (regio- e steroselettività); idratazione “diretta” di alchini: tautomeria cheto-enolica. Calcolo dell’indice di insaturazione di un composto.
Ossidazioni e Riduzioni: Generalità sul significato e le convenzioni utilizzate relativamente alle reazioni “redox” in chimica organica. Idrogenazione catalitica degli alcheni e loro stabilità relativa a seconda del grado di sostituzione (calori di idrogenazione). Idrogenazione catalitica e chimica di alchini. Ossidazione di alcheni: epossidazione con peracidi; sin-ossidrilazione via KMnO4 e OsO4 “a freddo”; scissione ossidativa con KMnO4 “a caldo”; ozonolisi e trattamento finale in condizioni ossidanti e riducenti. Scissione ossidativa di glicoli con acido periodico. Sintesi di alcoli con metalli attivi. Ossidazione di alcoli primari e secondari: uso di H2CrO4 e KMnO4; uso della PCC. Reattivo di Tollens. Determinazione del contenuto alcolico nel sangue. Utilità di idruri complessi (NaBH4 e LiAlH4) nella sintesi di alcoli. Potenzialità del DIBAL-H. Riduzione del gruppo carbonilico a metilenico: riduzione di Wolff-Kishner, desolforazione dei tioacetali, riduzione di Clemmensen.
Dieni Coniugati: Generalità: struttura e confronto di stabilità tra dieni isolati, coniugati e cumulati. Addizioni elettrofile: controllo cinetico e termodinamico.
Reazioni Radicaliche: Addizioni radicaliche di HBr ad alcheni. Alcani: combustione; alogenazione (regioselettività, principio di reattività-selettività nelle reazioni di clorurazione e bromurazione). Reazione di sostituzione in posizione allilica e benzilica: uso della NBS.
Sostituzione Nucleofila Alifatica Ionica e #946;-Eliminazioni: Generalità. Basicità e nucleofilicità. Meccanismi SN1 e SN2: fattori che influenzano le loro velocità relative (struttura del substrato, concentrazione e reattività del nucleofilo, effetto del solvente, effetto del gruppo uscente). Meccanismi E1 e E2 (requisiti stereoelettronici del substrato). Regioselettività: regola di Saytzeff (prodotti tipo Saytzeff ed Hofmann). Quadro generale delle competizioni SN2 vs. E2 e SN1 vs. E1. Eliminazione nei sistemi ciclici. Sintesi di eteri da alcolati e alogenuri alchilici (sintesi di Williamson) e per disidratazione di alcoli. Conversione di alcoli in alogenuri alchilici: uso di SOCl2 [in assenza (SNi), e in presenza di un’ammina 3a], uso di PBr3. Saggio di Lucas. Conversione di alcoli in tosilati. Sintesi di epossidi via aloidrine e reazioni di apertura dell’anello epossidico: condizioni basiche ed acide (regio- e sterochimica).
Principi di Analisi Retrosintetica: Generalità. Disconnessioni e trasformazioni di gruppi funzionali. Esempi di sintesi di alchini per alchilazione di acetiluri e per doppia deidroalogenazione di dialogenuri vicinali.
Reagenti Organometallici: Generalità. Reagenti di organolitio ed organomagnesiaci (reattivi di Grignard): preparazione, limiti e potenzialità. Organocuprati: preparazione ed utilità nella sintesi organica.
Acidi carbossilici e loro derivati funzionali: Sostituzione Nucleofila Acilica: principi generali e reattività relativa dei vari derivati carbossilici (cloruri acilici, anidridi, esteri e ammidi). Sintesi di cloruri acilici per trattamento di acidi con SOCl2 e loro trasformazione in: esteri, anidridi, chetoni, aldeidi e ammidi. Acidi carbossilici: sintesi per carbonatazione dei reattivi di Grignard. Anidridi: sintesi dell’acido acetilsalicilico. Esteri: idrolisi acida e basica (saponificazione), idrossammati e reazione di transesterificazione. Ammidi: idrolisi acida e basica. Idrolisi dei nitrili.
Addizioni Nucleofile al Gruppo Carbonilico: Generalità sull’addizione di nucleofili al gruppo carbonilico di aldeidi e chetoni. Addizione di reattivi di Grignard. Addizione di acqua (stabilità dei dioli geminali e caso del cloralio idrato). Addizione di alcoli: sintesi di emiacetali ed acetali (condizioni acide a basiche). Emiacetali ed acetali ciclici. Acetali come gruppi protettori. Addizione di ammine: sintesi di immine ed enammine. Addizione di HCN. Sintesi di idrazoni, fenilidrazoni, ossime e semicarbazoni. Amminazione riduttiva di derivati carbonilici nella sintesi di ammine.
Ammine: Sintesi per alchilazione di NH3, riduzione di nitrili e di azidi. Sintesi di Gabriel di ammine primarie. Saggio di Hinsberg.
Composti Carbonilici: Reazioni al Carbonio in #945;: Acidità di idrogeni in #945; al gruppo carbonilico. Tautomeria cheto-enolica acido e base-catalizzata (enoli ed enolati). #945;-Alogenazione di chetoni: catalisi acida e basica. Reazione aloformica. Enolati cineti e termodinamici: utilità della LDA. Reazione e condensazione aldolica: catalisi acida e basica. Condensazione aldolica incrociata. Addizioni nucleofile a composti carbonilici #945;,#946;-insaturi: addizioni 1,2 e addizioni 1,4 (controllo cinetico e termodinamico). Utilità delle enammine nella sintesi organica: reazione di Stork (alchilazione “indiretta” in #945; di derivati carbonilici, sintesi di composti #946;-dicarbonilici). Condensazione di Claisen. Saponificazione di #946;-chetoesteri e decarbossilazione di #946;-chetoacidi. Sintesi acetoacetica. Sintesi malonica.
Sostituzione Elettrofila Aromatica (SEAr): Generalità. Reazioni di sostituzioni elettrofila aromatica: alogenazione, nitrazione, solfonazione, alchilazione e acilazione di Friedel-Crafts (limiti e utilità sintetiche). Effetto dei sostituenti sulla reattività di benzeni mono- e disostituiti: gruppi attivanti e disattivanti, o- e p-orientanti, m-orientanti. Effetti elettronici ±I e ±M relativi a vari sostituenti e loro classificazione. Reazioni in posizione benzilica: alogenazione e ossidazione. Fenoli: sostituzione elettrofila aromatica su fenoli (alogenazione, nitrazione e solfonazione). Carbossilazione dei fenoli: reazione di Kolbe-Schmitt. Chinoni: generalità. Accorgimenti sperimentali nella sintesi di derivati benzenici polisostituiti. Sali di arildiazonio: reazione di diazotazione ed utilità nella sintesi organica; reazione di Sandmeyer, sintesi di fluorobenzeni e reazione di deamminazione. Reazione di diazocopulazione: generalità ed effetto del pH; coloranti azoici. Naftalene: struttura, energia di risonanza e reattività. SEAr su naftaleni: principi generali; effetto di sostituenti pre-esistenti sulla regioselettività di successive sostituzioni; reazioni di ossidazione di naftaleni sostituiti.
Sostituzione Nucleofila Aromatica: Principi generali. Meccanismo di addizione-eliminazione (SNAr attivata) e di eliminazione-addizione (meccanismo benzinico): esempi.
Sistemi Eterocicli: Generalità, classificazione e nomenclatura dei principali eterocicli saturi, insaturi ed aromatici. Struttura, aromaticità, energia di risonanza, basicità, acidità e reattività verso SEAr e SNAr di eterocicli aromatici pentatomici (furano, pirrolo, tiofene, imidazolo), esatomici (piridina) e sistemi condensati corrispondenti (chinolina e isochinolina). Reazione di Chichibabin e sue varianti. Utilità nella sintesi organica delle 2-amminopiridine. Tautomeria nelle 2-idrossipiridine. Cenni su pironi e cumarine.
#945;-Amminoacidi, Polipeptidi e Proteine: #945;-Amminoacidi: generalità, struttura, classificazione, stereochimica, proprietà acido-base, punto isoelettrico, concentrazione delle varie specie presenti in soluzione al variare del pH, titolazione, sintesi di Strecker, risoluzione cinetica. Polipeptidi e Proteine: natura e geometria del legame peptidico, determinazione della struttura primaria di una proteina (rottura di ponti disolfuro, scissione acida, cromatografia a scambio ionico, saggio della ninidrina, degradazione di Edman, reattivo di Sanger, utilità del BrCN e delle carbossipeptidasi). Struttura secondaria, terziaria e quaternaria di proteine: generalità.
Lipidi: Generalità e classificazione. Cere: generalità. Trigliceridi: struttura e proprietà, distinzione tra grassi ed olii, principali acidi grassi saturi e insaturi. Irrancidimento e indurimento degli olii. Cenni sulle vitamine liposolubili (A, E, D3 e K). Saponi: preparazione dei saponi naturali e loro proprietà detergenti. Detergenti sintetici (SDS, LAS). Fosfolipidi (lecitine e cefaline). Sfingolipidi (sfingomieline e cerebrosidi). Terpeni: generalità. Lipidi steroidei: generalità, struttura e stereochimica, colesterolo.
Carboidrati: Monosaccaridi: struttura, nomenclatura, proprietà chimico-fisiche e stereochimica dei più comuni aldosi e chetosi. Reazioni di riduzione: uso di NaBH4 nella formazione di alditoli. Reazioni di ossidazione: uso di Br2 e dei reattivi di Tollens e Fehling nella formazione di acidi aldonici e di HNO3 nella formazione di acidi aldarici. Utilità del periodato nella degradazione ossidativa di un monosaccaride. Formazione e utilità degli osazoni. Sintesi di Kiliani-Fischer modificata e degradazione di Ruff. Proiezioni di Haworth: strutture furanosiche e piranosiche. Mutarotazione e potere riducente di uno zucchero. Sintesi di O-glicosidi. Effetto anomerico. N-glicosidi: nucleosidi e nucleotidi. Disaccaridi: maltosio, isomaltosio, genziobiosio, cellobiosio, amigdalina, lattosio e saccarosio. Polisaccaridi: amido (amilosio e amilopectina), glicogeno, cellulosa, chitina.
ULTIMO IL TUO PROGRAMMA DI ORGANICA E' QUESTO E IL TUO ESAME E' DI 11 CREDITI... MA CMQ I CREDITI SONO DIVERSI DA QUELLI DI BIOLOGIA,VOI FATE DELLE COSE CHE NOI FACCIAMO IN BIOCHIMICA... oltre che delle cose in piu ed e' giusto per voi di farmacia che sia cosi' |

|
 |
|
|
Gabriele
Utente
 
Prov.: Pisa
Città: Pisa

615 Messaggi |
 Inserito il - 05 gennaio 2008 : 23:33:27 Inserito il - 05 gennaio 2008 : 23:33:27




|
| Anche il meccanismo di idrolisi delle enammine è l'esatto contrario di quello di sintesi,i passaggi delle reazioni di condensazione solitamente sono invertibili,come evidenziato dalle doppie frecce. |
"Chi rinuncia alla libertà per la sicurezza, non merita né la libertà né la sicurezza. E finirà col perdere entrambe." |
 |
|
|
Ultimo
Utente Junior


Prov.: Lecce
Città: Alezio

290 Messaggi |
 Inserito il - 06 gennaio 2008 : 17:05:06 Inserito il - 06 gennaio 2008 : 17:05:06





|
| GRAZIE Dionysos e Gabriele!!Se in questo forum ci fossero più persone concrete come voi e meno fanfaroni e chiacchieroni come Patrizio,ad esempio,andrebbe molto meglio.Patrizio grazie per avermi scritto il mio programma e da quanti crediti è,sai non lo sapevo!!Se te lo dici da solo che sei bravo è un pò grave..perchè anche se lo fossi davvero con un pò di umiltà varresti il doppio...dalle mie parti si dice "chi si vanta da solo non vale un fagiolo"......fai te!!Poi per due volte tho scritto enammine e tu mi rispondi ammine,forse per te sono sinonimi. |
 |
|
|
Patrizio
Moderatore
  

Città: Barcellona

1915 Messaggi |
 Inserito il - 06 gennaio 2008 : 18:41:52 Inserito il - 06 gennaio 2008 : 18:41:52





|
| prego per i crediti...... ok saro'poco umile e ti diro' che ho letto male |

|
 |
|
|
Ultimo
Utente Junior


Prov.: Lecce
Città: Alezio

290 Messaggi |
 Inserito il - 07 gennaio 2008 : 11:05:39 Inserito il - 07 gennaio 2008 : 11:05:39





|
Ciao..ho trovato sul libro questa domanda:se l'addizione elettrofila al benzene è globalmente una reazione endoergonica come può l'addizione elettrofila ad un alchene essere globalmente una reazione esoergonica?
mi servirebbe una mano..so che poichè nell'anello benzenico si perderebbe l'aromaticità risulta meno stabile e quindi nel complesso endoergonica..ma perchè l'addizione elettrofila ad alcheni è esoergonica?grazie a tutti |
 |
|
|
Ultimo
Utente Junior


Prov.: Lecce
Città: Alezio

290 Messaggi |
 Inserito il - 07 gennaio 2008 : 12:17:05 Inserito il - 07 gennaio 2008 : 12:17:05





|
| un'altra domanda:non mi sto trovando con l'elettronica del bromuro ferrico.quanti e quali sono gli elettroni di valenza?e perchè la carica formale del ferro nel bromuro ferrico (FeBr3) è 0 mentre quando il bromuro ferrico reagisce con Br2 (ad esempio per formare il reagente nell'alogenazione di benzeni) assume una carica formale -1 ? |
 |
|
|
Nick_row
Utente Junior



361 Messaggi |
 Inserito il - 07 gennaio 2008 : 23:48:30 Inserito il - 07 gennaio 2008 : 23:48:30




|
...insomma...siete tutti super geni e le vostre uni sono le migliori del mondo!!!BOOM!!! |
 |
|
|
Ultimo
Utente Junior


Prov.: Lecce
Città: Alezio

290 Messaggi |
 Inserito il - 08 gennaio 2008 : 17:59:11 Inserito il - 08 gennaio 2008 : 17:59:11





|
iuuu c'è nessunoo?qualcuno mi sa aiutare |
 |
|
|
Gabriele
Utente
 
Prov.: Pisa
Città: Pisa

615 Messaggi |
 Inserito il - 08 gennaio 2008 : 18:29:07 Inserito il - 08 gennaio 2008 : 18:29:07




|
Non voglio fare altra polemica però....questi dubbi perchè non li esponete ai vostri insegnanti?In fondo son pagati per questo. Non esiste il ricevimento studenti?
La risposta data da loro è la migliore,perchè solo loro sanno cosa vogliono sentirsi dire in sede d'esame.Io,come gli altri membri del forum, potrei rispondere in modo troppo superficiale o magari troppo approfondito per quelle che sono le loro idee e allora non avreste concluso nulla. |
"Chi rinuncia alla libertà per la sicurezza, non merita né la libertà né la sicurezza. E finirà col perdere entrambe." |
 |
|
|
Ultimo
Utente Junior


Prov.: Lecce
Città: Alezio

290 Messaggi |
 Inserito il - 08 gennaio 2008 : 18:47:36 Inserito il - 08 gennaio 2008 : 18:47:36





|
in tanti e tanti forum c'è uno scambio di idee e opinioni,si è vero sto studiando per l'esame ma queste domande che ho fatto non le voglio sapere perchè le devo dire all'esame ma per curiosità mia personale.non è polemica assolutamente. |
 |
|
|
Gabriele
Utente
 
Prov.: Pisa
Città: Pisa

615 Messaggi |
 Inserito il - 08 gennaio 2008 : 19:27:05 Inserito il - 08 gennaio 2008 : 19:27:05




|
Mi fa piacere la tua curiosità,la mia idea però rimane valida,perchè non chiedere innanzitutto a chi è deputato (e preparato) a spiegare la materia?
E' vero quel che dici dei forum,ricorda però che questo non è un forum che ha per tema principale la chimica. Non a caso, non è presente alcuna sezione dedicata ad essa. Questo non significa che non io non sia disposto a parlarne (ovviamente non posso parlare per gli altri),però è indicativo del fatto che,chi decide di rispondere,lo fa esclusivamente perchè ne ha tempo e voglia.Ci si deve quindi anche aspettare che, a certe domande, nessuno risponda. |
"Chi rinuncia alla libertà per la sicurezza, non merita né la libertà né la sicurezza. E finirà col perdere entrambe." |
 |
|
|
Ultimo
Utente Junior


Prov.: Lecce
Città: Alezio

290 Messaggi |
 Inserito il - 15 gennaio 2008 : 13:01:32 Inserito il - 15 gennaio 2008 : 13:01:32





|
| perchè gli intermedi carbocationici + stabili sono più reattivi dei meno stabili? |
 |
|
|
Gabriele
Utente
 
Prov.: Pisa
Città: Pisa

615 Messaggi |
 Inserito il - 15 gennaio 2008 : 14:06:17 Inserito il - 15 gennaio 2008 : 14:06:17




|
| Non sono più reattivi,si formano più facilmente, tutto qui. |
"Chi rinuncia alla libertà per la sicurezza, non merita né la libertà né la sicurezza. E finirà col perdere entrambe." |
 |
|
|
Ultimo
Utente Junior


Prov.: Lecce
Città: Alezio

290 Messaggi |
 Inserito il - 15 gennaio 2008 : 14:22:01 Inserito il - 15 gennaio 2008 : 14:22:01





|
forse sono riuscito a tracciare il grafico della reazione di solfonazione del naftalene,qualcuno mi può dire se è giusto?l'intermedio carbocationico derivante dall'attacco in alfa è più stabile di quello dell'attacco in beta (e naturalmente la barriera energetica per passare dai reagenti all'intermedio è più piccola che della barriera per arrivare all'intermedio carbocationico beta sosituito.)
A questo punto i due intermedi devono superare le stesse identiche energie di attivazione per essere convertiti in prodotti,il prodotto cinetico (con nucleofilo in alfa è meno stabile),il prodotto termodinamico (con nucleofilo in beta è più stabile) |
 |
|
|
Gabriele
Utente
 
Prov.: Pisa
Città: Pisa

615 Messaggi |
 Inserito il - 15 gennaio 2008 : 17:07:14 Inserito il - 15 gennaio 2008 : 17:07:14




|
| Guarda,ora non mi ricordo bene ma mi sembra che nel caso in esame quello che veramente condiziona il processo è il mantenimento di una struttura aromatica nel maggior numero possibile di intermedi. Questo avviene maggiormente nel caso della sostituzione C1 (o alfa). |
"Chi rinuncia alla libertà per la sicurezza, non merita né la libertà né la sicurezza. E finirà col perdere entrambe." |
 |
|
|
@driana
Nuovo Arrivato


2 Messaggi |
 Inserito il - 22 gennaio 2008 : 15:24:17 Inserito il - 22 gennaio 2008 : 15:24:17





|
Ciao a tutti!!
Io avrei bisogno di un'informazione riguardante la CONDSENSAZIONE ALDOLICA INCROCIATA:
dopo il primo passaggio di deprotonazione dell'idrogeno in alfa, successivamente ho un attacco elettrofilo o nucleofilo tra i due composti??
Grazie per l'aiuto!! |
 |
|
|
Ultimo
Utente Junior


Prov.: Lecce
Città: Alezio

290 Messaggi |
 Inserito il - 22 gennaio 2008 : 16:35:11 Inserito il - 22 gennaio 2008 : 16:35:11





|
| attacco nucleofilo,perchè il doppietto di elettroni si ribalta a formare un doppio legame con il carbonio carbonilico,e poichè il doppio legame è un gruppo funzionale nucleofilo aggangia il carbonio carbonilico di un aldeide o di un chetone.spero di essere stato chiaro.ciao. |
 |
|
|
@driana
Nuovo Arrivato


2 Messaggi |
 Inserito il - 22 gennaio 2008 : 19:40:09 Inserito il - 22 gennaio 2008 : 19:40:09





|
  Grazie mille!!Sei stato chiarissimo..infatti avevo scritto male io sugli appunti... Grazie mille!!Sei stato chiarissimo..infatti avevo scritto male io sugli appunti...
Per qualsiasi quesito, sempre di chimica mandami pure una mail...
Ciao!! |
 |
|
|
Rich
Nuovo Arrivato
Prov.: Cremona
Città: Soresina

1 Messaggi |
 Inserito il - 22 gennaio 2008 : 20:15:26 Inserito il - 22 gennaio 2008 : 20:15:26





|
Citazione:
Messaggio inserito da Patrizio
Legame covalente e polare e forma delle molecole organiche: Richiami sul legame chimico. Strutture di Lewis e calcolo della carica formale. Risonanza. Ibridazioni sp3, sp2 e sp del carbonio. Classificazione dei composti organici e panoramica dei loro gruppi funzionali (priorità relative nella nomenclatura).
Alcani e Cicloalcani: Struttura, nomenclatura IUPAC e tradizionale. Proprietà chimico-fisiche. Isomeria costituzionale negli alcani ed isomeria geometrica nei cicloalcani (requisiti). Differenza tra configurazioni e conformazioni. Conformazioni di alcani (etano, propano e butano): proiezioni di Newman (sfalsate, eclissate), a cunei e a cavalletto; diagrammi di energia potenziale. Cicloalcani: tensioni torsionali ed angolari per ciclopropano, ciclobutano, ciclopentano ed equilibri conformazionali in cicloesani mono-, di- e polisostituiti. Composti biciclici condensati, a ponte e spiro: struttura e nomenclatura.
Nomenclatura IUPAC e tradizionale e proprietà chimico fisiche di: alogenuri alchilici, alcoli, tioli, eteri, solfuri, ammine, derivati carbonilici (aldeidi e chetoni), acidi carbossilici e loro derivati (alogenuri acilici, anidridi, esteri, ammidi, nitrili), derivati stabili dell’acido carbonico (uree, carbonati, carbammati).
Composti Aromatici ed Eteroaromatici: Concetto di aromaticità, antiaromaticità, energia di risonanza. Ioni aromatici ed antiaromatici. Nomenclatura di benzeni mono-, di- e polisostituiti e dei principali composti eteroaromatici.
Chiralità e Stereoisomeria: Introduzione alla chiralità nella 1a, 2a e 3a dimensione. Chiralità e Stereogenicità: principi generali. Elementi di simmetria (centro, piano e assi semplici di simmetria) e loro compatibilità con la chiralità. Molecole dissimmetriche ed asimmetriche. Enantiomeri e diastereoisomeri. Proiezioni di Fischer. Configurazioni relative (sistema D,L) ed assolute (sistema R,S e regole di priorità). Polarimetro ed attività ottica. Purezza ed eccesso enantiomerico. Risoluzione ottica di miscele racemiche. Stereoisomeria nei sistemi aciclici con due o più stereocentri: forme treo, eritro, meso e carboni “pseudoasimmetrici”. Stereoisomeria nei sistemi ciclici. Enantiomeria e diastereoisomeria conformazionale nei cicloesani disostituiti. Isomeria geometrica negli alcheni (requisiti e nomenclatura E,Z). Attività ottica: requisiti. Molecole chirali in assenza di stereocentri: caso degli alleni chirali. Carboni prochirali, idrogeni enantiotopici e diastereotopici.
Acidità e Basicità in Chimica Organica: Generalità. Fattori strutturali ed elettronici che influenzano l’acidità e la basicità dei composti organici: elettronegatività, energia di legame, ibridazione, effetti induttivi (±I), effetti coniugativi (±M). Basicità di alcoli, di alchil- ed arilammine in fase gassosa e in soluzione: relazione tra DG° e pKa. Predizione della direzione degli equilibri in base ai valori di pKa.
Introduzione ai meccanismi di reazione: Richiami di termodinamica: reazioni eso- e endoergoniche, eso- e endotermiche, relazione tra energia libera standard e costante di equilibrio. Richiami di cinetica: energia libera di attivazione, velocità, ordine e molecolarità di reazione, stadio limitante la velocità di reazione, postulato di Hammond, stato di transizione e complesso attivato, intermedi di reazione.
Addizioni Elettrofile: Alcheni: struttura e reattività. Addizioni elettrofile ad alcheni (addizione ioniche di acidi alogenidrici: regioselettività, regola di Markovnikov, stabilità di carbocationi e loro trasposizioni; addizione di acqua ed alcoli; addizione di alogeni: regio- e steroselettività; formazioni di aloidrine; significato di addizioni sin e anti). Idroborazione-ossidazione di alcheni (regio- e steroselettività). Alchini: struttura, polarizzabilità e acidità di alchini terminali. Addizioni elettrofile ad alchini: generalità (confronto tra carbocationi alchilici e vinilici); addizione di acidi alogenidrici ed alogeni (regio- e steroselettività); idratazione “diretta” di alchini: tautomeria cheto-enolica. Calcolo dell’indice di insaturazione di un composto.
Ossidazioni e Riduzioni: Generalità sul significato e le convenzioni utilizzate relativamente alle reazioni “redox” in chimica organica. Idrogenazione catalitica degli alcheni e loro stabilità relativa a seconda del grado di sostituzione (calori di idrogenazione). Idrogenazione catalitica e chimica di alchini. Ossidazione di alcheni: epossidazione con peracidi; sin-ossidrilazione via KMnO4 e OsO4 “a freddo”; scissione ossidativa con KMnO4 “a caldo”; ozonolisi e trattamento finale in condizioni ossidanti e riducenti. Scissione ossidativa di glicoli con acido periodico. Sintesi di alcoli con metalli attivi. Ossidazione di alcoli primari e secondari: uso di H2CrO4 e KMnO4; uso della PCC. Reattivo di Tollens. Determinazione del contenuto alcolico nel sangue. Utilità di idruri complessi (NaBH4 e LiAlH4) nella sintesi di alcoli. Potenzialità del DIBAL-H. Riduzione del gruppo carbonilico a metilenico: riduzione di Wolff-Kishner, desolforazione dei tioacetali, riduzione di Clemmensen.
Dieni Coniugati: Generalità: struttura e confronto di stabilità tra dieni isolati, coniugati e cumulati. Addizioni elettrofile: controllo cinetico e termodinamico.
Reazioni Radicaliche: Addizioni radicaliche di HBr ad alcheni. Alcani: combustione; alogenazione (regioselettività, principio di reattività-selettività nelle reazioni di clorurazione e bromurazione). Reazione di sostituzione in posizione allilica e benzilica: uso della NBS.
Sostituzione Nucleofila Alifatica Ionica e #946;-Eliminazioni: Generalità. Basicità e nucleofilicità. Meccanismi SN1 e SN2: fattori che influenzano le loro velocità relative (struttura del substrato, concentrazione e reattività del nucleofilo, effetto del solvente, effetto del gruppo uscente). Meccanismi E1 e E2 (requisiti stereoelettronici del substrato). Regioselettività: regola di Saytzeff (prodotti tipo Saytzeff ed Hofmann). Quadro generale delle competizioni SN2 vs. E2 e SN1 vs. E1. Eliminazione nei sistemi ciclici. Sintesi di eteri da alcolati e alogenuri alchilici (sintesi di Williamson) e per disidratazione di alcoli. Conversione di alcoli in alogenuri alchilici: uso di SOCl2 [in assenza (SNi), e in presenza di un’ammina 3a], uso di PBr3. Saggio di Lucas. Conversione di alcoli in tosilati. Sintesi di epossidi via aloidrine e reazioni di apertura dell’anello epossidico: condizioni basiche ed acide (regio- e sterochimica).
Principi di Analisi Retrosintetica: Generalità. Disconnessioni e trasformazioni di gruppi funzionali. Esempi di sintesi di alchini per alchilazione di acetiluri e per doppia deidroalogenazione di dialogenuri vicinali.
Reagenti Organometallici: Generalità. Reagenti di organolitio ed organomagnesiaci (reattivi di Grignard): preparazione, limiti e potenzialità. Organocuprati: preparazione ed utilità nella sintesi organica.
Acidi carbossilici e loro derivati funzionali: Sostituzione Nucleofila Acilica: principi generali e reattività relativa dei vari derivati carbossilici (cloruri acilici, anidridi, esteri e ammidi). Sintesi di cloruri acilici per trattamento di acidi con SOCl2 e loro trasformazione in: esteri, anidridi, chetoni, aldeidi e ammidi. Acidi carbossilici: sintesi per carbonatazione dei reattivi di Grignard. Anidridi: sintesi dell’acido acetilsalicilico. Esteri: idrolisi acida e basica (saponificazione), idrossammati e reazione di transesterificazione. Ammidi: idrolisi acida e basica. Idrolisi dei nitrili.
Addizioni Nucleofile al Gruppo Carbonilico: Generalità sull’addizione di nucleofili al gruppo carbonilico di aldeidi e chetoni. Addizione di reattivi di Grignard. Addizione di acqua (stabilità dei dioli geminali e caso del cloralio idrato). Addizione di alcoli: sintesi di emiacetali ed acetali (condizioni acide a basiche). Emiacetali ed acetali ciclici. Acetali come gruppi protettori. Addizione di ammine: sintesi di immine ed enammine. Addizione di HCN. Sintesi di idrazoni, fenilidrazoni, ossime e semicarbazoni. Amminazione riduttiva di derivati carbonilici nella sintesi di ammine.
Ammine: Sintesi per alchilazione di NH3, riduzione di nitrili e di azidi. Sintesi di Gabriel di ammine primarie. Saggio di Hinsberg.
Composti Carbonilici: Reazioni al Carbonio in #945;: Acidità di idrogeni in #945; al gruppo carbonilico. Tautomeria cheto-enolica acido e base-catalizzata (enoli ed enolati). #945;-Alogenazione di chetoni: catalisi acida e basica. Reazione aloformica. Enolati cineti e termodinamici: utilità della LDA. Reazione e condensazione aldolica: catalisi acida e basica. Condensazione aldolica incrociata. Addizioni nucleofile a composti carbonilici #945;,#946;-insaturi: addizioni 1,2 e addizioni 1,4 (controllo cinetico e termodinamico). Utilità delle enammine nella sintesi organica: reazione di Stork (alchilazione “indiretta” in #945; di derivati carbonilici, sintesi di composti #946;-dicarbonilici). Condensazione di Claisen. Saponificazione di #946;-chetoesteri e decarbossilazione di #946;-chetoacidi. Sintesi acetoacetica. Sintesi malonica.
Sostituzione Elettrofila Aromatica (SEAr): Generalità. Reazioni di sostituzioni elettrofila aromatica: alogenazione, nitrazione, solfonazione, alchilazione e acilazione di Friedel-Crafts (limiti e utilità sintetiche). Effetto dei sostituenti sulla reattività di benzeni mono- e disostituiti: gruppi attivanti e disattivanti, o- e p-orientanti, m-orientanti. Effetti elettronici ±I e ±M relativi a vari sostituenti e loro classificazione. Reazioni in posizione benzilica: alogenazione e ossidazione. Fenoli: sostituzione elettrofila aromatica su fenoli (alogenazione, nitrazione e solfonazione). Carbossilazione dei fenoli: reazione di Kolbe-Schmitt. Chinoni: generalità. Accorgimenti sperimentali nella sintesi di derivati benzenici polisostituiti. Sali di arildiazonio: reazione di diazotazione ed utilità nella sintesi organica; reazione di Sandmeyer, sintesi di fluorobenzeni e reazione di deamminazione. Reazione di diazocopulazione: generalità ed effetto del pH; coloranti azoici. Naftalene: struttura, energia di risonanza e reattività. SEAr su naftaleni: principi generali; effetto di sostituenti pre-esistenti sulla regioselettività di successive sostituzioni; reazioni di ossidazione di naftaleni sostituiti.
Sostituzione Nucleofila Aromatica: Principi generali. Meccanismo di addizione-eliminazione (SNAr attivata) e di eliminazione-addizione (meccanismo benzinico): esempi.
Sistemi Eterocicli: Generalità, classificazione e nomenclatura dei principali eterocicli saturi, insaturi ed aromatici. Struttura, aromaticità, energia di risonanza, basicità, acidità e reattività verso SEAr e SNAr di eterocicli aromatici pentatomici (furano, pirrolo, tiofene, imidazolo), esatomici (piridina) e sistemi condensati corrispondenti (chinolina e isochinolina). Reazione di Chichibabin e sue varianti. Utilità nella sintesi organica delle 2-amminopiridine. Tautomeria nelle 2-idrossipiridine. Cenni su pironi e cumarine.
#945;-Amminoacidi, Polipeptidi e Proteine: #945;-Amminoacidi: generalità, struttura, classificazione, stereochimica, proprietà acido-base, punto isoelettrico, concentrazione delle varie specie presenti in soluzione al variare del pH, titolazione, sintesi di Strecker, risoluzione cinetica. Polipeptidi e Proteine: natura e geometria del legame peptidico, determinazione della struttura primaria di una proteina (rottura di ponti disolfuro, scissione acida, cromatografia a scambio ionico, saggio della ninidrina, degradazione di Edman, reattivo di Sanger, utilità del BrCN e delle carbossipeptidasi). Struttura secondaria, terziaria e quaternaria di proteine: generalità.
Lipidi: Generalità e classificazione. Cere: generalità. Trigliceridi: struttura e proprietà, distinzione tra grassi ed olii, principali acidi grassi saturi e insaturi. Irrancidimento e indurimento degli olii. Cenni sulle vitamine liposolubili (A, E, D3 e K). Saponi: preparazione dei saponi naturali e loro proprietà detergenti. Detergenti sintetici (SDS, LAS). Fosfolipidi (lecitine e cefaline). Sfingolipidi (sfingomieline e cerebrosidi). Terpeni: generalità. Lipidi steroidei: generalità, struttura e stereochimica, colesterolo.
Carboidrati: Monosaccaridi: struttura, nomenclatura, proprietà chimico-fisiche e stereochimica dei più comuni aldosi e chetosi. Reazioni di riduzione: uso di NaBH4 nella formazione di alditoli. Reazioni di ossidazione: uso di Br2 e dei reattivi di Tollens e Fehling nella formazione di acidi aldonici e di HNO3 nella formazione di acidi aldarici. Utilità del periodato nella degradazione ossidativa di un monosaccaride. Formazione e utilità degli osazoni. Sintesi di Kiliani-Fischer modificata e degradazione di Ruff. Proiezioni di Haworth: strutture furanosiche e piranosiche. Mutarotazione e potere riducente di uno zucchero. Sintesi di O-glicosidi. Effetto anomerico. N-glicosidi: nucleosidi e nucleotidi. Disaccaridi: maltosio, isomaltosio, genziobiosio, cellobiosio, amigdalina, lattosio e saccarosio. Polisaccaridi: amido (amilosio e amilopectina), glicogeno, cellulosa, chitina.
ULTIMO IL TUO PROGRAMMA DI ORGANICA E' QUESTO E IL TUO ESAME E' DI 11 CREDITI... MA CMQ I CREDITI SONO DIVERSI DA QUELLI DI BIOLOGIA,VOI FATE DELLE COSE CHE NOI FACCIAMO IN BIOCHIMICA... oltre che delle cose in piu ed e' giusto per voi di farmacia che sia cosi'
|
 |
|
|
chimy9
Nuovo Arrivato

9 Messaggi |
 Inserito il - 29 gennaio 2009 : 17:34:51 Inserito il - 29 gennaio 2009 : 17:34:51




|
Ciao a tutti!
Sto preparando l'esame di chimica organica e c'è un argomento che proprio non mi entra in testa e nn trovo spiegato bene da nessuna parte, cioè tutta la storia di reazione stereoselettiva, stereospecifica, anti, sin e la conseguenza nelle reazioni (cioè formazione di composti otticamente attivo o meno).
Vi riporto cosa ho scritto negli appunti a riguardo perchè vorrei capire se ho scritto io male e capire il perchè di alcune cose.
Una reazione stereoselettiva è una reazione in cui si ha una % maggiore di uno stereoisomero rispetto ad un altro, quindi si ha la formazione preferenziale di uno dei 2.
Una reazione stereospecifica, invece, è una reazione per cui ciascun stereoisomero del reagente è in grado di dare solo un particolare stereoisomero.
Poi ho scritto una cosa che non ho letto da nessuna parte, nemmeno sul mio libro-mattone e vorrei capire se ha qualche parvenza di verità:
Se il composto di partenza è cis si ottiene una coppia di enantiomeri.
Se la coppia di partenza è trans, si ottiene la forma meso.
Il tutto l'ho scritto nella lezione riguardante l'addizione di alogeni agli alcheni.
In essa si avrà come risultato sempre la forma trans e mai la cis, perchè?
Mentre nell'addizione di H2 ad un alchene avremo la forma meso (cioè la sin). Perchè?
Mi scuso in anticipo se alcune cose sono prive di significato ma vorrei capire se qualcosa di vero c'è!
Se qualcuno può farmi un riassunto di tutte queste cose in maniera più precisa gli sarà grata!
Grazie in anticipo a chi risponderà :) |
 |
|
|
Discussione |
|
|
|
Quanto è utile/interessante questa discussione:
| MolecularLab.it |
© 2003-24 MolecularLab.it |
 |
|
|







