Quanto è utile/interessante questa discussione:
| Autore |
Discussione |
|
|
stemesca
Nuovo Arrivato

7 Messaggi |
 Inserito il - 14 febbraio 2012 : 12:29:29 Inserito il - 14 febbraio 2012 : 12:29:29




|
Ciao a tutti,
Sono nuovo del forum e spero di trovare qualcuno che abbia la pazienza di aiutarmi...
Per una tesi ho condotto il seguente esprimento:
30 soggetti portano delle lenti a contatto di tipo A, poi il giorno dopo di tipo B.
Raccolte le lenti analizzo i depositi che presentano con due diversi metodi: metodo "UV 280nm", metodo "ninidrina". Trascuro le differenze tra i due occhi e considero per ogni soggetto il valore quantità di depositi per la lente A e quella B
Esempio:
Metodo 1 Sogg.1 Lente A = 20ug; B = 35ug;
Metodo 2 Sogg.1 Lente A = 18ug; B = 12ug;
Analisi dei dati:
Ho eseguito il test t student 2 code x dati non accopiati per i risultati del metodo 1 per vedere se vi son differenze tra la lente A e quella B. La stessa cosa per metodo 2.
Ma poiché son gli stessi soggetti che hanno portato le lenti come posso correlare i risultati del primo metodo con quelli del secondo?
Nota:
Il secondo metodo é molto sensibile e soggetto a più errori sperimentali, ho dovuto scartare delle misure. Perciò la mia numerosità é 30 sogg. per il test 1 e circa 20 per il test 2.
Grazie in anticipo!
|
|
|
|
|
Glubus
Utente Junior



156 Messaggi |
 Inserito il - 15 febbraio 2012 : 11:16:45 Inserito il - 15 febbraio 2012 : 11:16:45




|
Bello! Peccato che non spieghi le ipotesi di lavoro: riguardano le lenti, i metodi di analisi dei depositi o entrambi?
Ci sono comunque un bel po' di considerazioni da fare:
1) La sequenza (prima lenti A poi lenti B): si sottointende quindi -e può essere certamente valido su base biologica - che l'effetto della lente A non si "trascini" nel giorno dopo (carryover effect).
2) Come fai a trascurare le differenze fra i due occhi? (è ragionevole pensare che i due occhi possano avere secrezioni e drenaggio lacrimale leggermente diversi)
3) NON puoi applicare il t-test per il fatto che i dati non sono indipendenti (che è una assunzione del t-test). Potresti al limite usare un t-test per dati appaiati o equivalentemente fare la differenza (A-B) per ogni soggetto e testare l'ipotesi nulla che la differenza sia 0. In questo modo testeresti in modo separato le due ipotesi, il che è un po' grezzo.
4) Dovresti probabilmente chiedere aiuto ad uno statistico: qui si entra nel campo dei modelli ad effetti misti, che sono un po' avanzati per un non-statistico. In particolare dovresti considerare che ogni soggetto (e ogni occhio in quel soggetto) può avere un "proprio" livello di secrezione (che possiamo pensare come variabile casuale, il cui apporto può essere misurato in termini di variabilità, condizionalmente agli effetti "fissi" e cioè lente e metodo).
5) Se il tuo interesse è sulla metodologia analitica esistono metodi più informativi di studiare il diverso comportamento delle due metodiche (Bland-Altman, ad esempio).
Stefano
Citazione:
Messaggio inserito da stemesca
Ciao a tutti,
Sono nuovo del forum e spero di trovare qualcuno che abbia la pazienza di aiutarmi...
Per una tesi ho condotto il seguente esprimento:
30 soggetti portano delle lenti a contatto di tipo A, poi il giorno dopo di tipo B.
Raccolte le lenti analizzo i depositi che presentano con due diversi metodi: metodo "UV 280nm", metodo "ninidrina". Trascuro le differenze tra i due occhi e considero per ogni soggetto il valore quantità di depositi per la lente A e quella B
Esempio:
Metodo 1 Sogg.1 Lente A = 20ug; B = 35ug;
Metodo 2 Sogg.1 Lente A = 18ug; B = 12ug;
Analisi dei dati:
Ho eseguito il test t student 2 code x dati non accopiati per i risultati del metodo 1 per vedere se vi son differenze tra la lente A e quella B. La stessa cosa per metodo 2.
Ma poiché son gli stessi soggetti che hanno portato le lenti come posso correlare i risultati del primo metodo con quelli del secondo?
Nota:
Il secondo metodo é molto sensibile e soggetto a più errori sperimentali, ho dovuto scartare delle misure. Perciò la mia numerosità é 30 sogg. per il test 1 e circa 20 per il test 2.
Grazie in anticipo!
|
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
|
|
stemesca
Nuovo Arrivato

7 Messaggi |
 Inserito il - 15 febbraio 2012 : 15:37:41 Inserito il - 15 febbraio 2012 : 15:37:41




|
@Globus
Grazie per la spegazione, molto chiara.
Cerco di fornire qualche info in più...
Citazione:
Peccato che non spieghi le ipotesi di lavoro: riguardano le lenti, i metodi di analisi dei depositi o entrambi?
L'obbiettivo dello studio é valutare la diversa attittudine ai depositi che i 2 diversi tipi di lenti hanno.
Utilizzando 2 metodi diversi si vuole anche fare un confronto tra i 2 metodi, i due metodi danno gli stessi risultati?
Citazione:
1) La sequenza (prima lenti A poi lenti B): si sottointende quindi -e può essere certamente valido su base biologica - che l'effetto della lente A non si "trascini" nel giorno dopo (carryover effect)
Si può escludere questo tipo di effetto, ovvero l'occhio ritorna in condizioni normali dopo qualche ora.
Citazione:
2) Come fai a trascurare le differenze fra i due occhi? (è ragionevole pensare che i due occhi possano avere secrezioni e drenaggio lacrimale leggermente diversi)
Esatto! ma non ci interessa ai fini di questo lavoro...
Citazione:
NON puoi applicare il t-test per il fatto che i dati non sono indipendenti (che è una assunzione del t-test). Potresti al limite usare un t-test per dati appaiati o equivalentemente fare la differenza (A-B) per ogni soggetto e testare l'ipotesi nulla che la differenza sia 0. In questo modo testeresti in modo separato le due ipotesi, il che è un po' grezzo.
Ok per il test t accopiato!
Citazione:
Se il tuo interesse è sulla metodologia analitica esistono metodi più informativi di studiare il diverso comportamento delle due metodiche (Bland-Altman, ad esempio).
Ho allegato un file xls dove ha fatto la Bland-Altman. Se hai tempo/voglia dacci un occhio. Altrimenti ti chiedo solo:
Va fatta per i risultati complessivi sia con lente A e B per confrontare i due metodi oppure é più corretto farla A con A eppoi a parte B con B.
Nel file l'ho fatta con i risultati complessivi. Se guardi il file mi faresti un commento ai diagrammi? non sono di così immediata comprensione...
Grazie ancora per il tuo aiuto.
Stefano
(anch'io)
Allegato:  Prova.xls Prova.xls
376,05 KB |
 |
|
|
Glubus
Utente Junior



156 Messaggi |
 Inserito il - 15 febbraio 2012 : 16:38:34 Inserito il - 15 febbraio 2012 : 16:38:34




|
Bland & Altman forniscono il metodo (corretto, dopo la prima versione che conteneva un errore) per osservazioni ripetute sulo stesso soggetto in questo articolo del 1999 che ti conviene leggere anche per interpretare i grafici che hai prodotto. L'articolo è abbastanza semplice dal punto di vista statistico, anche se lunghetto e te lo allego.
Nel file di excel che hai mandato non è chiara l'dentificazione del soggetto (anche se immagino un soggetto corrisponda ad una coppia di righe A-B) mentre sarebbe interessante avere sia le misurazioni per ogni occhio (invece della variabile derivata "media" o "somma dei due occhi"), l'identificazione di ogni soggetto e anche i valori relativi alle osservazioni "scartate" (nel senso che se per un soggetto*lente hai solo il valore relativo ad un metodo proviamo a non sacrificare anche l'osservazione relativa all'altro metodo, ...).
Ti dovrei anche chiedere se nello specifico settore uno dei due metodi di misurazione sia considerato "standard", perché questo cambierebbe un po' l'approccio, Se non è così e quindi non sappiamo quale dei due sia più "affidabile" (anche se non abbiamo definito "affidabile") nota dal grafico che un metodo (NIV) sovrastima costantemente i valori di residui rispetto all'altro e che questa sovrastima aumenta all'aumentare dei valori dei residui stessi. Questo suggerisce l'idea di applicare una trasformazione logaritmica alla variabile "residuo organico", ...
Se vuoi provare a mandare il file come te l'ho richiesto magari proviamo a ragionarne.
Stefano
Citazione:
Messaggio inserito da stemesca
@Globus
Grazie per la spegazione, molto chiara.
Cerco di fornire qualche info in più...
Citazione:
Peccato che non spieghi le ipotesi di lavoro: riguardano le lenti, i metodi di analisi dei depositi o entrambi?
L'obbiettivo dello studio é valutare la diversa attittudine ai depositi che i 2 diversi tipi di lenti hanno.
Utilizzando 2 metodi diversi si vuole anche fare un confronto tra i 2 metodi, i due metodi danno gli stessi risultati?
Citazione:
1) La sequenza (prima lenti A poi lenti B): si sottointende quindi -e può essere certamente valido su base biologica - che l'effetto della lente A non si "trascini" nel giorno dopo (carryover effect)
Si può escludere questo tipo di effetto, ovvero l'occhio ritorna in condizioni normali dopo qualche ora.
Citazione:
2) Come fai a trascurare le differenze fra i due occhi? (è ragionevole pensare che i due occhi possano avere secrezioni e drenaggio lacrimale leggermente diversi)
Esatto! ma non ci interessa ai fini di questo lavoro...
Citazione:
NON puoi applicare il t-test per il fatto che i dati non sono indipendenti (che è una assunzione del t-test). Potresti al limite usare un t-test per dati appaiati o equivalentemente fare la differenza (A-B) per ogni soggetto e testare l'ipotesi nulla che la differenza sia 0. In questo modo testeresti in modo separato le due ipotesi, il che è un po' grezzo.
Ok per il test t accopiato!
Citazione:
Se il tuo interesse è sulla metodologia analitica esistono metodi più informativi di studiare il diverso comportamento delle due metodiche (Bland-Altman, ad esempio).
Ho allegato un file xls dove ha fatto la Bland-Altman. Se hai tempo/voglia dacci un occhio. Altrimenti ti chiedo solo:
Va fatta per i risultati complessivi sia con lente A e B per confrontare i due metodi oppure é più corretto farla A con A eppoi a parte B con B.
Nel file l'ho fatta con i risultati complessivi. Se guardi il file mi faresti un commento ai diagrammi? non sono di così immediata comprensione...
Grazie ancora per il tuo aiuto.
Stefano
(anch'io)
Allegato:  Prova.xls Prova.xls
376,05 KB
Allegato:  BA1999.pdf BA1999.pdf
354,51 KB |
 |
|
|
stemesca
Nuovo Arrivato

7 Messaggi |
 Inserito il - 15 febbraio 2012 : 17:12:11 Inserito il - 15 febbraio 2012 : 17:12:11




|
Grazie per la pazienza e per il file.
L'identificazione dei soggetti é come dicevi e nel file allegato ho comunque evidenziato ogni soggetto.
Di dati relativi all'altro occhio non ne ho, sono tutti valori provenienti dall'occhio destro e non ci sono valori scartati.
(le lenti portate sul sinistro sono state utilizzate per quantificare il colesterolo presente sulle lenti, come indicatore della deposizione lipidica).
I due metodi non sono standard, quindi non darei precedenza all'uno o altro e anche se l'analisi spettroscopica UV delle proteine a 280nm é molto diffusa non costituisce uno standard nell'analisi su lenti a contatto.
I valori espressi sono di assorbanze dello strumento (spettrofotometro) ovvero unità arbitrarie e sono i valori lordi.
Infatti per procedere alla quantificazione dei depositi proteici, devo sottrarre l'assorbanza di lenti nuove non utilizzate (che costituiscono dei bianchi o riferimenti) eppoi mediante retta di taratura calcolare la concentrazione di proteine nel mio campione e quindi su di una lente.
I valori negativi (pochi con UV, un po' di più con l'altro) saltano fuori quando io ad esempio ho una lente utilizzata che assorbe 0,040 e una lente nuova non utilizzata che assorbe 0,050! (non é teoricamente possibile che accada ciò ma a livello sperimentale si é verificato!) forse per contaminazione dei campioni, errore nelle misuare, nel dosare i reagenti etc...
Allegato:  RisultatiML.rar RisultatiML.rar
988,85 KB |
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 15 febbraio 2012 : 17:42:08 Inserito il - 15 febbraio 2012 : 17:42:08




|
Citazione:
saltano fuori quando io ad esempio ho una lente utilizzata che assorbe 0,040 e una lente nuova non utilizzata che assorbe 0,050! (non é teoricamente possibile che accada ciò ma a livello sperimentale si é verificato!)
Non è così rara come cosa, succede quando le concentrazioni sono basse. Io in quei casi metterei il valore = 0, perchè una concentrazione negativa non ha fisicamente senso. |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
stemesca
Nuovo Arrivato

7 Messaggi |
 Inserito il - 15 febbraio 2012 : 18:03:34 Inserito il - 15 febbraio 2012 : 18:03:34




|
Citazione:
Io in quei casi metterei il valore = 0,
E' stato il mio primo pensiero, poi li ho eliminati, però forse é più corretto tenere la misura a 0 in effetti...altrimenti rischio di alzare inultimente la media dei miei valori. |
 |
|
|
Glubus
Utente Junior



156 Messaggi |
 Inserito il - 16 febbraio 2012 : 08:32:44 Inserito il - 16 febbraio 2012 : 08:32:44




|
prima di ogni analisi vedi se questo grafico ti ispira qualcosa (soprattutto la sovrastima di un metodo rispetto all'altro  ) )
Citazione:
Messaggio inserito da stemesca
Citazione:
Io in quei casi metterei il valore = 0,
E' stato il mio primo pensiero, poi li ho eliminati, però forse é più corretto tenere la misura a 0 in effetti...altrimenti rischio di alzare inultimente la media dei miei valori.
Immagine:
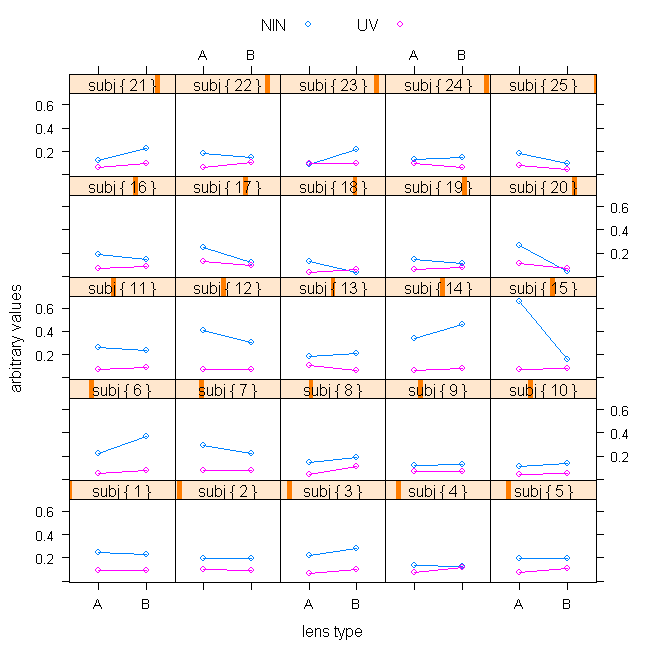
10,19 KB |
 |
|
|
stemesca
Nuovo Arrivato

7 Messaggi |
 Inserito il - 16 febbraio 2012 : 09:31:21 Inserito il - 16 febbraio 2012 : 09:31:21




|
Citazione:
prima di ogni analisi vedi se questo grafico ti ispira qualcosa (soprattutto la sovrastima di un metodo rispetto all'altro )
Il grafico rende chiaramente la sovrastima e permette di vedere immediatamente se i due metodi sono in accordo (rette con pendenza dello stesso segno) sul modello di lente con più depositi oppure no (rette con pendenza di segno opposto). Quindi direi che é molto esplicativo e sintetico allo stesso tempo tempo!
Un commento ai risultati (e non alla loro rappresentazione): i due metodi sono in accordo per poco più della metà dei soggetti e questo non é così piacevole, quello che mi piacerebbe estrapolare dall'analisi deti é il trend che ogni metodo dimostra nella valutazione dei depositi.
Appare chiaro e penso significativo stat. che il test UV trovi più depositi nella lente B
Possiamo dire lo stesso per il test alla ninidrina?
|
 |
|
|
stemesca
Nuovo Arrivato

7 Messaggi |
 Inserito il - 16 febbraio 2012 : 09:49:06 Inserito il - 16 febbraio 2012 : 09:49:06




|
Forse ho commesso un errore grave.
La sovrastima del metodo NIN nei valori di assorbanza non si traduce poi in effettiva sovrastima dei valori in termine di ug di proteine lente. Quindi forse la rappresentazione e il confronto più corretto sarebbe in ug e non in unità arbitrarie. Ti ho fornito direttamente i valori di assorbanza per evitare di dover trattare i valori negativi che nel metodo nin capitavano spesso.
Esempio Soggetto 1
UV
(a)0,088 (b)0,090 i cui riferimenti lenti non usate sono(a)0,063 (b)0,038
valore netto (a)0,025 (b)0,052 che sono corrispondenti a ug/lente (a)48,66 (b)118,93
NIN
(a)0,244 (b)0,228 riferimenti (a)0,155 (b)0,203 valore netto(a)0,089 (b)0,025 che sono corrispondenti a (a)54,4 (b)13,9
Sparita la sovrastima!
|
 |
|
| |
Discussione |
|
|
|
Quanto è utile/interessante questa discussione:
| MolecularLab.it |
© 2003-24 MolecularLab.it |
 |
|
|





