29 giugno 2009 - 11:39 am
Abbiamo ancora alcune tipologie di tossine batteriche da vedere, oggi le vedremo tutte: le tossine con azione sul citoscheletro, la tossina carbonchiosa, le tossine neurotrope e i superantigeni
Alterazione del citoscheletro
La maggior parte delle tossine batteriche che agiscono sul citoscheletro hanno un meccanismo A-B, ma le due subunità sono secrete separate e si uniscono solo in prossimità della membrana cellulare, sono tutte ADP-ribosil-transferasi e il loro bersaglio è l’actina. Il prototipo di questo tipo di tossine è la tossina C2 di Clostridium botulinum. Il batterio secerne C2I e C2II (rispettivamente subunità A e B) separati, quando C2II lega il recettore lega anche C2I e ne causa l’ingresso. L’azione di C2I è tale che causa morte cellulare molto rapidamente e, nelle cavie, il DL50 della tossina si aggira intorno a 5-50 ng.
Da ricordare inoltre il fattore citotossico necrotizzante (CNF-1 e CNF-2) di ceppi uropatogeni di Escherichia coli, che agisce sul signaling di membrana tramite proteine G, e la tossina dermonecrotica di Bordetella spp.
Esotossina carbonchiosa
L’esotossina del Bacillus anthracis è composta da tre distinte componenti, nessuno dei quali tossico di per sé: Edema Factor (EF), o fattore I; Protective Antigen (PA), o fattore II; Lethal Factor (LF), o fattore III. EF e LF sono il componente A della tossina, mentre PA è il componente B. Il meccanismo d’azione (qui un’immagine) è piuttosto complesso:
PA, una proteina di circa 83 kDa, lega un recettore (ATR, anthrax toxin receptor) e viene attaccato da una proteasi che ne taglia via circa 20 kDa. la parte rimanente, chiamata p63, è ora in grado di legare EF e LF, avvenuto il legame la tossina è endocitata nella cellula.
EF è una adenilato ciclasi attivata dalla calmodulina, che aumenta la concentrazione di cAMP, la cui conseguenza è l’edema.
LF è una metalloproteasi capace di attivare la cascata di segnale delle MAP kinasi, sfociando nella attivazione del fattore NF-κB. Il bersaglio preferito dalla tossina batterica è rappresentato dai macrofagi, che con l’attivazione di NF-κB, rilasciano ingenti quantità di citochine, tra cui il tumor necrosis factor-α e l’interleuchina-1β (TNF-α e IL-1β), che portano a shock e sono responsabili della letalità della tossina. La tossina del carbonchio è prodotta dal plasmide pX-01, mentre il plasmide pX-02 produce la capsula, che è un altro fattore di virulenza del batterio. La perdita di pX-01 per le alte temperature porta alla formazione di un batterio attenuato non virulento, la perdita di pX-02 invece porta ad una virulenza ridotta, da questi si può ricavare un vaccino.
 Tossine neurotrope
Tossine neurotrope
Due specie di Clostridium producono le tossine neurotrope: C. tetanii e C. botulinum, i quali rispettivamente producono tossine capaci di causare una paralisi spastica o flaccida.
Per capire come funzionano queste due tossine prima di tutto bisogna capire come funziona il movimento muscolare collegandolo al sistema nervoso centrale. Mettiamo il caso in cui vogliamo flettere un braccio. Normalmente il cervello manderà i suoi impulsi alla spina dorsale, da lì partirà il nervo che passerà l’impulso alla giunzione neuromuscolare e darà il comando al bicipite di contrarsi. Il tricipite risponde con una distensione. Questa distensione manda un impulso al midollo spinale che chiede una nuova contrazione, che non avviene solo perché esiste, sempre nel midollo spinale, un neurone che ha ricevuto l’impulso dal cervello di inibire questa contrazione riflessa e che agisce sugli stessi motoneuroni su cui agisce l’impulso riflesso di contrazione.
C. tetanii produce una tossina di 150 kDa, che viene tagliata in due parti (Heavy o H e Light o L) di 50 e 100 kDa, unite da un ponte disolfuro, di cui la più pesante funziona come parte B della tossina. La tossina tetanica agisce legando i recettori dell’acido γ-amminobutirrico (GABA) nelle sinapsi tra i neuroni inibitori della contrazione riflessa e i motoneuroni: il risultato è che tutti i muscoli sono contratti contemporaneamente (paralisi spastica) portando alla classica posa del malato grave di tetano (opistotono qui) e che comincia con una smorfia sulle labbra chiamata trisma.
C. botulinum è ampiamente presente e produce una proteina capace di resistere agli acidi dello stomaco, ma non alle alte temperature (quindi non presente negli alimenti trattati in maniera adeguata): il botulino è quindi una intossicazione alimentare. La tossina botulinica ha un DL50 bassisimo, per il topo è di circa 10-10 g, e questo ne fa una delle tossine più potenti in natura. La sua azione è quella di inibire il rilascio di acetilcolina nei motoneuroni, questo porta all’impossibilità di contrarre qualunque muscolo e ad una paralisi chiamata paralisi flaccida.
Superantigeni
Alla classe dei superantigeni appartengono alcune enterotossine staffilococciche (SE) e la tossina dello shock tossico (TSST) di Staphilococcus aureus, le tossine pirogene streptococciche (SPE) e il superantigene streptococcico di Streptococcus pyogenes. La dicitura di “superantigene” è data loro perché attivano in maniera abnorme il sistema immunitario, causando una elevatissima secrezione di citochine e interleuchine che a loro volta causano shock. Il motivo di questo meccanismo è che formano un ponte tra l’MHC delle cellule presentanti l’antigene (APC) come i macrofagi e il TCR dei linfociti. Normalmente il legame TCR-antigene-MHC è breve e specifico, perché il recettore del linfocita è molto selettivo, il linfocita si moltiplica e produce citochine. Questo superantigene invece lega una regione di MHC che normalmente non fa parte della normale presentazione dell’antigene, con la conseguenza che lega il TCR in maniera aspecifica (quindi lega tutti i linfociti presenti, indipendentemente dalla loro specificità) e più intensa (qui un’immagine). Questo, oltre a portare uno shock per l’azione della gigantesca attivazione linfocitaria, porta anche ad un abbassamento delle difese immunitarie, perché la moltiplicazione è stata aspecifica, e quindi c’è un effetto diversivo rispetto all’infezione in atto
Fonti: La Placa – Principi di microbiologia medica
Tags:
antrace,
botulino,
carbonchio,
citoscheletro,
superantigeni,
tetano,
tossine batteriche
 Commenti disabilitati
Commenti disabilitati
3 maggio 2009 - 10:22 am
Per chi volesse saperne di più sull’influenza suina sono disponibili una serie di link, divulgativi e di aggiornamento, che possono sicuramente essere utili.
Le notizia più aggiornate le trovate nelle pagine del WHO, del CDC e dell’ECDC
WHO: disease outbreaks news
CDC: H1N1 flu
ECDC: Outbreaks of Influenza A(H1N1) virus
Il primo link porta agli aggiornamenti mondiali della situazione, il secondo è uno sguardo più statunitense e il terzo si riferisce più all’Europa. Il secondo ed il terzo però mettono i dati in una tabella, probablmente più chiara del solo elenco di nomi e numeri che fa il WHO, e per questo più immediatamente comprensibili. Dal sito dell’ECDC si evince inoltre che in Italia c’è stato un caso confermato (cosa non riportata, ancora, nell’ultimo aggiornamento del WHO) e la cosa interessante è che mostra anche i casi di contagio interumano: attualmente 5 su un totale di 49 casi confermati e 14 sospetti. Si conferma quindi la possibilità del virus di infettare gli uomini passando da persona a persona, ma si conferma anche il fatto che questo passaggio sia piuttosto difficile.
Per quanto riguarda informazioni generali su questa influenza esistono molti siti consultabili, ad esempio questa pagina di Molecularlab, dove ci sono le risposte dle ministero della salute alle domande più frequenti. Esse si riferiscono alle conoscenze generali sulle influenze suine, la situazione della malattia attuale è leggermente diversa (ad esempio ormai si sa che può avere trasmissione interumana), ma è comunque una buona fonte di informazioni.
In questo blog poi ci sono tre post riguardanti l’influenza suina che riportano link interessanti e discussioni riguardo H1N1, potrebbero essere un’utile approfondimento sia dal punto di vista scientifico che dal punto di vista divulgativo
A few more flu links
A bunch of flu links
How bad is the flu?
Tra gli strumenti che gli scenziato possono usare per combattere quest’influenza c’è senza dubbio la banca dati del genoma dei virus influenzali, nato per l’influenza aviaria, ma ora utilizzato per combattere ogni tipo di pandemia, o possibile tale, data dai virus influenzali, messa a punto dalla dottoressa Ilaria Capua dell’istituto zooprofilattico delle Venezie.
Infine, ovviamente, tutti gli strumenti che internet da sono utili per informarsi e per conoscere le notizie di prima mano: Twitter è in ogni minuto aggiornato da ogni parte del mondo da moltissime persone, una massa enorme di link da cui a volte è difficile distinguere le informazioni vere da quelle pubblicitarie o complottiste, ma che comunque rappresenta una fonte infinita di informazioni (tra l’altro, anche il CDC usa questo canale per le notizie immediate). Inoltre Google ha messo a punto una mappa quasi in tempo reale per gli aggiornamenti riguardanti la diffusione della malattia.
Tags:
influenza suina,
orthomyxovirus,
risorse online
30 aprile 2009 - 10:32 am
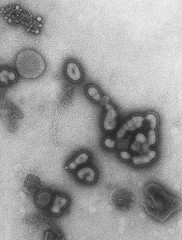 Scusate l’assenza, la spiegazione delle tossine batteriche riprenderà presto, ora voglio parlare di Influenza suina. Qualunque altro intervento nei commenti è bene accetto: correzioni, aggiunte, domande e risposte.
Scusate l’assenza, la spiegazione delle tossine batteriche riprenderà presto, ora voglio parlare di Influenza suina. Qualunque altro intervento nei commenti è bene accetto: correzioni, aggiunte, domande e risposte.
L’influenza è un virus abbastanza versatile, a seconda del ceppo può infettare umani, volatili e suini. Le epidemie degli anni passati di aviaria sono state caratterizzate da una forte virulenza a fronte però di una difficoltosa infettività: era necessario, come ho letto da qualche parte, “limonarsi una gallina infetta” per infettarsi. L’influenza suina è un ceppo più simile a quello umano (H1N1, a seconda dei sottotipi, si diffonde facilmente anche tra gli umani e fa parte delle classiche influenze), questo la rende più facilmente trasmissibile da uomo a uomo. Non che la cosa sia facile, intendiamoci, ma è possibile (che è comunque più di quanto non sia per l’aviaria). Traduco l’ultimo comunicato dell’Organizzazione Mondiale della Sanità
29 Aprile 2009 — La situazione continua ad evolversi rapidamente. Alle ore 18:00 GMT [Ora di Greenwich, in Italia le attuali 20:00] del 29 aprile 2009 nove paesi hanno riportato ufficialmente 148 casi di infezione da influenza suina A/H1N1. Il governo degli Stati Uniti ha riportato 91 casi umani confermati in laboratorio, con un morto. Il Messico ha riportato 26 casi di infezione tra umani con 7 morti.
I seguenti paesi hanno riportato casi confermati in laboratorio senza nessun morto: Austria (1), Canada (13), Germania (3), Israele (2), Nuova Zelanda (3), Spagna (4) e Regno unito (5)
Ulteriori informazioni sulla situazione saranno disponibili sul sito dell’OMS regolarmente.
L’OMS non da restrizioni particolari per quanto riguarda i viaggi o la chiusura delle frontiere. E’ considerato prudente per le persone malate il rimandare i viaggi internazionali e, per le persone che sviluppano sintomi viaggiando, fare un controllo medico, in linea con le linee guida delle autorità nazionali.
Non c’è alcun rischio di infezione da questo virus dal consumo di maiale ben cotto e dei prodotti di origine suina. Le persone comunque hanno la raccomandazione di lavarsi le mani con acqua e sapone regolarmente e dovrebbero chiedere cure mediche se dovessero sviluppare sintomi simil-influenzali
Questo è l’ultimo comunicato ufficiale, preso da qui.
In tutto questo, però, il livello di pandemia è ora a 5, su una scala di 6: effettivamente c’è contagio interumano e le nazioni colpite sono molte, ma c’è un fatto da considerare: il contagio interumano è raro. Solo in Messico la cosa è stata evidente, in Europa, poi, i casi sono tutti di persone tornate dalle americhe, e non hanno infettato nessuno.
Insomma, la guardia è alta, i farmaci ci sono (anche se non specifici), i cordoni sanitari sono stati allertati e, come dicono all’OMS, è la prima volta che abbiamo una rete di comunicazione così efficiente da poter far fronte senza paura ad una possibile pandemia. Ai consigli finali del comunicato voglio aggiungere una raccomandazione: se siete in messico e cucinate maiale, non usate lo stesso coltello per altre cose! E un’ultima aggiunta: sintomi simil-influenzali non vuol dire mal di pancia, vomito e diarrea, ma tosse, mal di gola, raffreddore, febbre alta, dolori muscolari e spossatezza. Se da tre giorni andate al bagno 5 volte al giorno non è influenza.
Tags:
influenza suina,
orthomyxovirus,
WHO
31 dicembre 2008 - 12:43 pm
Esistono diverse esotossine batteriche che agiscono a livello del citosol, interferendo con il normale metabolismo cellulare. A seconda del batterio e della cellula bersaglio gli effetti sono diversi: alterazioni del contenuto di cAMP, inibizione della sintesi proteica, azione neurotropa. Inoltre esistono tossine che agiscono da superantigene, e la tossina carbonchiosa che ha un effetto peculiare. In questi ultimi due post sulle tossine batteriche vedremo di capire meglio come funzionano, cercherò di essere il più chiaro possibile.
Alterazione del contenuto di cAMP
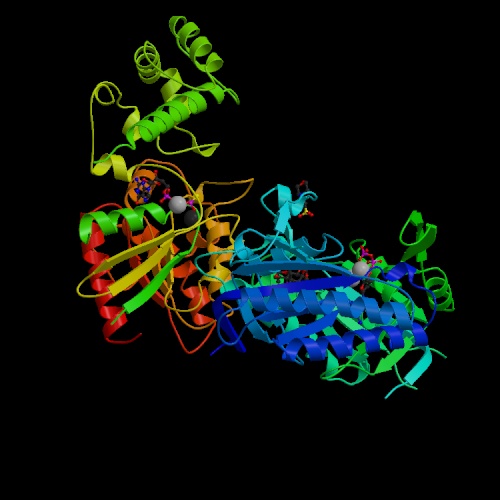
Esistono due gruppi di tossine capaci di modificare il contenuto di cAMP: le prime sono tossine che hanno un’attività enzimatica ADP-ribosilante, le quali agiscono alterando la funzionalità di una serie di proteine G preposte alla regolazione dell’adenilato-ciclasi; le seconde sono invece tossine che hanno una attività adenilato-ciclasica intrinseca.
Della prima specie di tossine fanno parte la tossina colerica, la tossina pertossica e la tossina termolabile (LT) di Escherichia coli. Il minimo comun denominatore tra loro è che sono tutte tossine di tipo A-B: sono divisibili infatti in due tipi di domini, quelli denominati con A sono importanti per l’azione tossica all’interno della cellula, ma non sono in grado di entrarvi senza la parte B della proteina, senza cioè i domini capaci di riconoscere i recettori, ma che di per sé non hanno attività tossica.
La tossina colerica e la LT hanno azioni molto simili. Le proteine G sono composte da tre subunità: α, che può avere azione stimolatoria (αs) o inibitoria (αi) sull’adenilato-ciclasi, e il complesso βγ che va ad attivare varie cascate di segnale. Le due tossine hanno come bersaglio la subunità αs delle cellule intestinali, di fatto attivandola perennemente. La conseguente attivazione dell’adenilato-ciclasi aumenta la concentrazione di cAMP e, come conseguenza, il contenuto di elettroliti cellulare si altera: ioni e acqua escono dalla cellula superando la capacità di assorbimento del colon e causando una diarrea molto grave, che può portare a morte per disidratazione.
La tossina pertossica è prodotta da Bordetella pertussis e il suo bersaglio è invece la subunità inibitoria, o αi, delle proteine G, di fatto inattivandola. Le cellule bersaglio sono varie, cambiano quindi gli effetti: inibizione della fagocitosi dei macrofagi, leucocitosi, aumentata produzione di insulina… Comunque il bersaglio iniziale è la mucosa tracheo-bronchiale, che quindi porta, come conseguenza, alla pertosse.
Della seconda specie fanno parte l’edema factor (EF) della tossina carbonchiosa, che vedremo più avanti, e la tossina adenilato-ciclasi/emolisina, chiamata anche ciclolisina, prodotta anche questa da B. pertussis. Le conseguenze dell’azione adenilato-ciclasica sono le stesse della tossina pertossica, l’azione emolitica è data dalla sua capacità di creare pori nelle cellule eucariotiche, dei quali si pensa si serva per entrare nelle cellule.
Inibizione della sintesi proteica

Le tossine che inibiscono la sintesi proteica sono la tossina difterica, prodotta dal Corynebacterium diphtheriae, la tossina A, prodotta da Pseudomonas aeruginosa, e la tossina di Shiga prodotta da Shigella dysenteriae e le tossine Shiga-like (SLT o tossine Vero) prodotte dai ceppi di Escherichia coli enteroemorragici.
La tossina difterica e la tossina A hanno un meccanismo molto simile: entrambe hanno una struttura A-B ed entrambe hanno una attività ADP-ribosilante non dissimile da quella colerica, ma il bersaglio è la proteina EF-2, fondamentale per la sintesi proteica. Il complesso EF-2-ADP-ribosio che ne risulta inattiva l’allungamento della sintesi proteica, portando quindi a morte la cellula.
La tossina di Shiga e le SLT hanno invece un meccanismo molto diverso. Entrano nelle cellule per endocitosi mediata da recettori ed hanno un’attività catalitica N-glicosidasica, il cui bersaglio è l’RNA ribosomiale 28s, contenuto nella subunità 60s. Il taglio al 3′ dell’rRNA 28s causa un mancato legame, EF-1 dipendente, dell’aminoacil-tRNA al sito A del ribosoma, bloccando quindi la sintesi proteica con conseguente morte cellulare.
Approfondimenti
Adenosin monofosfato ciclico (inglese)
Proteina G (inglese)
Sintesi proteica (video)
Fonti: La Placa – Principi di microbiologia medica
Tags:
adenilato ciclasi,
cAMP,
colera,
difterite,
esotossine,
pertosse,
proteine G,
sintesi proteica
18 novembre 2008 - 10:57 am
Nello scorso post abbiamo visto il funzionamento dell’endotossina batterica, ora invece prenderemo in esame le esotossine.
Esotossine batteriche
Esistono molteplici tipi di esotossine, tutte di natura proteica. In generale hanno ottime proprietà antigeniche, sono termolabili (ad eccezione dell’enterotossine staffilococciche) e vengono distrutte dai succhi gastrici (tranne per le enterotossine staffilococciche e per la tossina botulinica). Le azioni di queste proteine sono varie, esistono infatti principalmente due tipi di interazioni con le cellule ospiti: a livello di membrana e a livello di citosol. Le prime possono, ad esempio, alterare i legami intercellulari, danneggiare la membrana o interferire con il signaling cellulare, le altre invece interferiscono con meccanismi di regolazione enzimatica andando a modificare il metabolismo cellulare.
Bersaglio: membrana cellulare
Le esotossine che hanno come bersaglio la struttura superficiale delle cellule sono di due tipi: tossina esfoliativa e le tossine emolitiche
La tossina esfoliativa è prodotta dallo Staphylococcus aureus (in alto un modello), è monomerica e ne esistono due tipi, chiamati A e B. E’ la causa della cosiddetta sindrome della cute (pseudo)ustionata da stafilococco (staphylococcal scalded skin syndrome o SSSS), conosciuta anche come malattia di Ritter o malattia di Lyell. E’ una patologia tipica degli infanti ed è dovuta alla diffusione tramite il sangue della tossina (indipendente, quindi, dalla reale posizione dei batteri nell’organismo). L’azione dannosa, risultante esattamente come ampie ustioni sulla pelle, è data dall’interazione con le proteine della matrice intercellulare a livello dello strato granuloso dell’epidermide: la stabilità dello strato è compromessa e la pelle si danneggia al minimo insulto meccanico. Continue Reading »
Tags:
emolisine,
esotossine,
Staphylococcus aureus,
tossina emolitica,
tossina esfoliativa
29 ottobre 2008 - 5:39 pm
Prima di tutto voglio scusarmi: ho abbandonato questo blog a giugno e per una serie di ragioni non ho potuto riprendere a curarlo fino ad ora. Però eccomi qui, e sinceramente non vedevo l’ora di ricominciare a scrivere.
Da oggi parliamo di tossine batteriche. E’ un argomento molto vasto, credo che mi ci vorranno vari post per esaurirlo, ma credo che sia uno degli argomenti più affascinanti. I batteri infatti possono essere dannosi in molti modi, a volte basta la colonizzazione di un qualche tessuto, a volte invadono le cellule, a volte scatenano reazioni immunitarie molto forti, tali da danneggiare l’ospite, ma esistono alcune molecole che vengono prodotte dai batteri che sono dei veri e propri veleni, che di per sé, senza la presenza del patogeno, sono in grado di fare danni e che spesso sono il solo o il principale bersaglio delle terapie messe in atto per la cura di una qualche malattia.
Esistono due tipi di tossine: l’endotossina e le esotossine. La distinzione tra la prima e le altre è che l’endotossina è una componente dei batteri, precisamente è una parte della parete dei Gram negativi: l’LPS o lipopolisaccaride; le esotossine sono invece prodotti proteici e svolgono la loro azione tossica quando vengono eliminati all’esterno della cellula, spesso coinvolgendo vari enzimi cellulari.

Continue Reading »
Tags:
endotossina,
Gram-negativo,
lipopolisaccaride,
LPS,
TLR,
tossine
24 giugno 2008 - 12:01 pm
 La trasformazione è, nelle cellule eucariotiche, quel complesso processo che, passaggio dopo passaggio, porta alla nascita di cellule incapaci di inibizione da contatto, in continua proliferazione e sempre più indifferenziate: le cellule tumorali. Ci sono infinite cause della trasformazione cellulare: lo smog cittadino, il fumo, agenti chimici comuni quali ad esempio l’asbesto, l’alimentazione ricca di carne… tutte queste cause, e molte altre, hanno in comune la capacità di interferire con il DNA o con il ciclo cellulare, cambiando il normale svolgimento dei processi di replicazione e mitosi (o anche interferendo con l’apoptosi), oppure dannegiando fisicamente l’acido nucleico. Esistono molti virus che interagendo con il ciclo cellulare o con il DNA riescono a causare tumori: il più famoso, quello che è balzato agli onori della cronaca nell’ultimo anno, è il papillomavirus umano (HPV), riconosciuto come causa unica del cancro alla cervice uterina. Piccola curiosità per quelli che fanno colture cellulari in laboratorio: le cellule HeLa sono cellule di cancro alla cervice, quindi hanno integrato parti del genoma di HPV (rif: pdf).
La trasformazione è, nelle cellule eucariotiche, quel complesso processo che, passaggio dopo passaggio, porta alla nascita di cellule incapaci di inibizione da contatto, in continua proliferazione e sempre più indifferenziate: le cellule tumorali. Ci sono infinite cause della trasformazione cellulare: lo smog cittadino, il fumo, agenti chimici comuni quali ad esempio l’asbesto, l’alimentazione ricca di carne… tutte queste cause, e molte altre, hanno in comune la capacità di interferire con il DNA o con il ciclo cellulare, cambiando il normale svolgimento dei processi di replicazione e mitosi (o anche interferendo con l’apoptosi), oppure dannegiando fisicamente l’acido nucleico. Esistono molti virus che interagendo con il ciclo cellulare o con il DNA riescono a causare tumori: il più famoso, quello che è balzato agli onori della cronaca nell’ultimo anno, è il papillomavirus umano (HPV), riconosciuto come causa unica del cancro alla cervice uterina. Piccola curiosità per quelli che fanno colture cellulari in laboratorio: le cellule HeLa sono cellule di cancro alla cervice, quindi hanno integrato parti del genoma di HPV (rif: pdf).
Virus oncogeni a DNA
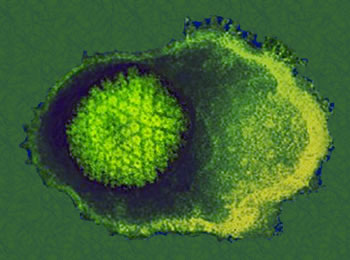 Sono i più numerosi, tra i virus capaci di trasformazione ricordiamo gli Hepadnavirus (HBV), gli Herpesvirus (Epstein-Barr, EBV, e Human Herpesvirus 8, HHV8) e quelli che una volta venivano chiamati PaPoVA (Papilloma, Polyoma e Vacuolating Agents).
Sono i più numerosi, tra i virus capaci di trasformazione ricordiamo gli Hepadnavirus (HBV), gli Herpesvirus (Epstein-Barr, EBV, e Human Herpesvirus 8, HHV8) e quelli che una volta venivano chiamati PaPoVA (Papilloma, Polyoma e Vacuolating Agents).
Il virus del’epatite B, HBV, è forse il virus a DNA con la replicazione più complessa (ne parleremo più avanti), e può causare cancro al fegato in due modi. Il primo modo è diretto: il DNA del virus si integra nel DNA cellulare, una volta integrato presenta modificazioni nelle regioni a lui adiacenti (mutazioni, delezioni, ricombinazioni…) creando instabilità, inoltre una sua proteina, codificata dal gene X, può dimerizzare con la proteina p53 delle cellule, inibendo la sua funzione di controllore del ciclo cellulare e allo stesso tempo attiva i geni proliferativi c-myc, c-fos e c-jun. Ovviamente la conseguenza più immediata dell’inserzione del DNA virale potrebbe essere la rottura di un gene, con conseguente perdita di funzionalità, e se tale gene è importante per la regolazione del ciclo cellulare, allora si potrebbe scatenare una proliferazione incontrollata.
Il secondo modo è indiretto: il virus cronicizza e causa la cirrosi epatica. In questo caso la causa scatenante sarebbe una trasformazione causata da metaplasia (il processo di cicatrizzazione sostituisce il tessuto originale con tessuto cicatriziale, soprattutto nei primi periodi questo processo è chiamato “metaplasia”, che è una condizione instabile: può degenerare in neoplasia).
Altri virus epatici possono causare tumore, interferendo con la regolazione del ciclo cellulare.
Epstein-Barr è il virus della monoucleosi infettiva, infetta i linfociti B. E’ associato al linfoma di Burkitt, perché l’infezione può causare immortalizzazione dei linfociti. Infatti, in assenza di una adeguata risposta immunitaria che elimini le cellule infette (quindi ad esempio in casi di AIDS), rimane per lo più silente nella cellula, il DNA non si integra quasi mai e produce piccole quantità di proteine. Queste proteine sono capaci di attivare oncogeni cellulari, tra cui bcl-2 e c-myc, inibendo l’apoptosi e causando una proliferazione incontrollata delle cellule.
Finiamo la carrellata con il Papillomavirus. Come nella maggior parte dei virus a DNA, hanno due tipi di trascriti: early e late (E e L), a seconda che siano precocemente o tardivamente trascriti, rispetto al ciclo virale. Tra le proteine E troviamo le responsabili della capacità trasformante del virus: E5 va ad inserirsi in membrana e interferisce con proteine di segnale di proliferazione (ad esempio stimola il segnale dal PDGFR, o platelet derived growth factor receptor); E6 lega p53 inattivandola; E7 lega un altra proteina oncosoppressore: RB, che è un regolatore negativo della trascrizione. I ceppi di HPV più frequenti nei tumori sono HPV-16 e HPV-18.
Virus oncogeni a RNA
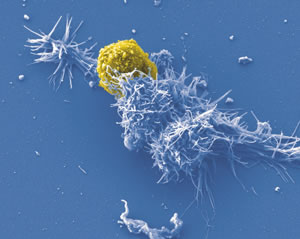 Sono tutti retrovirus, e nell’uomo il più comune è lo Human T-cell Leukemia Virus (HTLV-1 e HTLV-2), e come dice il nome, causa leucemie. Tutti i retrovirus che causano tumore sono chiamati Oncovirus e possono agire in tre modi
Sono tutti retrovirus, e nell’uomo il più comune è lo Human T-cell Leukemia Virus (HTLV-1 e HTLV-2), e come dice il nome, causa leucemie. Tutti i retrovirus che causano tumore sono chiamati Oncovirus e possono agire in tre modi
Possono portare integrato nel loro genoma una copia di un oncogene cellulare (v-onc): una volta integrato, questo gene si trova sotto il controllo del promotore virale e quindi la sua sintesi è molto maggiore rispetto alle condizioni normali. Il virus che porta l’oncogene, però, risulta difettivo (porta un gene cellulare invece di un gene virale), quindi ha bisogno di un virus helper per la replicazione completa.
La seconda classe è composta da quei virus che si integrano in prossimità del gene c-onc, aumentandone quindi la trascrizione.
Infine, nel caso di HTLV, non c’è un oncogene integrato nel proprio genoma e non si integra in prossimità dell’oncogene, ma produce un trans-attivatore capace di attivare la trascrizione degli oncogeni cellulari.
Una possibile motivazione
La domanda sorge spontanea: ma perché un virus dovrebbe causare il cancro? Cosa gliene viene? Lo scopo di ogni parassita è quello di mantenere il proprio ospite vivo il più a lungo possibile, per poter avere il tempo di diffondersi, perché causare il cancro?
Ho già accennato, nei post “Ma cos’è un virus?” (1, 2, 3), al fatto che i virus hanno spesso bisogno di una cellula in attiva replicazione per moltiplicarsi: una cellula in fase G1, o peggio in G0, non ha pronti i meccanismi molecolari capaci di replicare il genoma, cosa indispensabile per la replicazione virale. Ecco infatti che quasi tutti i virus interferiscono con il ciclo cellulare o con la sintesi delle proteine, inibendo quella cellulare e concentrando la fabbrica cellulare su di loro. E cosa c’è di meglio di un cancro per un virus che cerca una cellula in attiva proliferazione?
Fonti: La Placa – Principi di microbiologia medica
Tags:
ciclo cellulare,
oncogene,
oncosoppresore,
oncovirus,
virus oncogeni
30 maggio 2008 - 10:59 am
In quest’ultima parte prenderemo in esame cosa succede dopo un attacco da parte di un virus nell’organismo ospite. Le conseguenze di un’infezione virale per la cellula sono quasi sempre letali, ma ci sono aspetti cromosomici, metabolici e citologici da esaminare, inoltre le cellule sono spesso in grado di reagire con meccanismi molecolari.
Morte cellulare

Le proteine del virus possono avere un effetto tossico, ad esempio alcune proteine di Rotavirus agiscono come enterotossine. Il virus può indurre la cellula all’autodigestione lisando i lisosomi o inducendo quello che è chiamato effetto citopatico: dopo l’infezione la cellula cambia la sua morfologia aumentando o diminuendo il volume, conseguentemente spesso le cellule si staccano dal substrato.
Durante l’infezione poi, possono venirsi a formare quelli che sono chiamati corpi inclusi, che non sono altro che la traccia visibile dell’assemblaggio dei virus. Ne esistono di diverse forme, localizzazioni e composizioni, possono essere infatti sia acidofili che basofili. Tra i più noti possiamo ricordare i corpi del Guarnieri, acidofili, del Vaiolo o i corpi del Negri, basofili, della rabbia.
Le cellule infettate possono fondersi tra di loro. La fusione cellulare è abbastanza comune nei virus, è causata dalle proteine esterne che si inseriscono in membrana durante la replicazione ed ha una conseguenza piuttosto ovvia: facilitare la diffusione virale alle cellule limitrofe senza dover uscire all’esterno, quindi evitando la sorveglianza del sistema immunitario. Può avvenire sia dall’esterno, quindi durante l’adsorbimento, sia dall’interno, quando il virus ha prodotto le proteine di fusione che vanno in membrana sulla cellula ospite.
Infine, le cellule cambiano il loro metabolismo. Molte volte, durante un’infezione, si ha uno stop completo della sintesi proteica cellulare, a causa dell’azione delle proteine virali. Questo shut off virale consente al virus di indirizzare tutto il meccanismo di sintesi proteica verso la sua replicazioni, aumentandone quindi l’efficienza. Un altro cambiamento metabolico è quello a carico della replicazione cellulare: un virus ha bisogno delle proteine cellulari per replicare, va da se che se la cellula non replica molti virus non sono in grado di completare il loro ciclo, così inducono loro la mitosi.
Altre conseguenze
La cellula può anche non morire: il virus può instaurare una infezione cronica (permanente) all’interno di essa e riprendere la replicazione solo in condizioni favorevoli. Uno su tutti è il virus herpetico (Herpes simplex virus, HSV), che dopo la prima infezione va ad annidarsi nel nervo trigemino e non c’è modo di eliminarlo. Sotto alcuni stimoli (immunosoppressione, raggi ultravioletti, stress) il virus ricomincia a replicare, e migrando attraverso il nervo arriva alla mucosa labiale, dove causa le notissime lesioni.
Inoltre un virus può causare trasformazione cellulare, inducendo quindi anche alcune forme di cancro, come il cancro al fegato da epatite B, o il cancro al collo dell’utero, causato dal paillomavirus.
Difese
L’organismo di difende in vari modi dall’infezione virale, sia usando le armi del sistema immunitario, tipicamente gli anticorpi, sia con meccanismi generali della cellula, il più noto è l’interferone (IFN).
Non andremo in dettaglio, mi riserbo di parlare anche un po’ di immunologia, per ora dico solo che l’interferone esiste in tre tipi diversi, uno di questi è specifico di linfociti natural killer e linfociti T, gli altri sono prodotti da praticamente tutti i tipi cellulari. L’azione dell’interferone è sulle cellule adiacenti a quella infettata: questa manda un segnale tramite IFN alle altre cellule, che rispondono attivando degli enzimi capaci di bloccare sul nascere la replicazione virale.
Come ho già detto, i dettagli li vedremo più avanti, ora però voglio aggiungere che alcuni virus hanno sviluppato a loro volta difese contro l’IFN, segno evidente della coevoluzione degli organismi.
Tags:
corpi inclusi,
effetto citopatico,
IFN
21 maggio 2008 - 7:52 pm
In questa seconda parte cercherò di fare una panoramica molto generale delle strategie replicative dei virus. Premetto che per forza di cose questa sarà una trattazione sommaria, dovrei spendere ben più di un post sull’argomento per essere esauriente, e non è detto che in futuro non si faccia. Per il momento mi interessa dare le informazioni essenziali, in modo da mettere almeno alcuni puntelli di base, importanti per qualunque cosa ci sia già scritta (o sarà scritta) in questo blog.
Adsorbimento e penetrazione
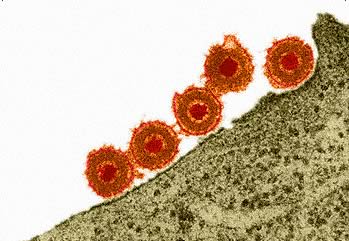 La prima cosa che un virus fa è prendere contatto con la superficie cellulare. L’adsorbimento virale avviene quando il virus lega il suo recettore tramite le spicole. Una volta legato il recettore, comincia la fase di penetrazione. Esistono vari tipi di penetrazione: la maggior parte dei fagi, ad esempio, inocula il genoma all’interno del batterio, lasciando all’esterno le proteine del capside (nei fagi T pari, ad esempio, avviene un processo che sembra una vera e propria iniezione, con la parte elicoidale del capside che si contrae nel momento di inoculo del DNA), quasi tutti i virus umani invece entrano con il capside (o nucleocapside) intatto e, se esiste l’envelope, questo si fonde con la membrana cellulare, altrimenti il virus può entrare stimolando l’endocitosi mediata dalla clatrina cellulare. In ogni caso, il processo replicativo inizia solo quando il virus è dentro la cellula: lo ripeto ancora una volta, nessun virus può replicare al di fuori della cellula bersaglio.
La prima cosa che un virus fa è prendere contatto con la superficie cellulare. L’adsorbimento virale avviene quando il virus lega il suo recettore tramite le spicole. Una volta legato il recettore, comincia la fase di penetrazione. Esistono vari tipi di penetrazione: la maggior parte dei fagi, ad esempio, inocula il genoma all’interno del batterio, lasciando all’esterno le proteine del capside (nei fagi T pari, ad esempio, avviene un processo che sembra una vera e propria iniezione, con la parte elicoidale del capside che si contrae nel momento di inoculo del DNA), quasi tutti i virus umani invece entrano con il capside (o nucleocapside) intatto e, se esiste l’envelope, questo si fonde con la membrana cellulare, altrimenti il virus può entrare stimolando l’endocitosi mediata dalla clatrina cellulare. In ogni caso, il processo replicativo inizia solo quando il virus è dentro la cellula: lo ripeto ancora una volta, nessun virus può replicare al di fuori della cellula bersaglio.
I recettori per i virus possono essere i più disparati, e definiscono lo spettro d’ospite (cioè il tipo di cellule che può essere infettato). Esistono recettori specifici, e quindi il virus può infettare uno o pochi tipi cellulari, mentre esistono recettori pressoché ubiquitari, in questo caso il virus che ne fa uso ha uno spettro d’sopite molto ampio. Alcuni Rhabdovirus sono addirittura capaci di infettare delle piante!
Replicazione del genoma e assemblaggio
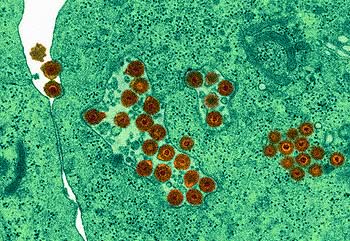
Se si va nel dettaglio si scopre che quasi ogni virus ha il suo modo di procedere, ma esistono comunque delle linee generali, che sono quelle che a questo livello ci interessano. Prima di tutto è necessario distinguere i virus a DNA da quelli ad RNA.
Virus a DNA
Con una unica eccezione, ogni virus a DNA ha bisogno del nucleo della cellula. Una volta entrato nel citoplasma, quindi, il DNA viene (con vari sistemi) trasportato nel nucleo, dove può essere trascritto dagli enzimi cellulari. La prima fase prevede la sintesi degli enzimi necessari alla replicazione (early phase), ogni virus sintetizza quello che gli serve per replicarsi (polimerasi, DNA binding proteins…). Ovviamente la sintesi avviene come per le cellule: viene trascritto l’RNA, questo esce dal nucleo, i ribosomi traducono la proteina e questa rientra nel nucleo.
La fase successiva (late phase) vede la vera e propria replicazione del DNA e la sintesi delle proteine strutturali.
Per l’assemblaggio del virus non c’è una vera e propria regola: può avvenire sia nel nucleo che nel citoplasma, a seconda del virus coinvolto.
Abbiamo detto di una unica eccezione, che è il Poxvirus: esso è un virus particolarmente grande, talmente grande da portare al suo interno molti degli enzimi necessari per la sua replicazione, ragione per cui replica nel citoplasma e non nel nucleo.
Virus a RNA
Un virus a RNA, invece, normalmente replica nel citoplasma, cioè dove sono presenti i ribosomi. Si distinguono virus a RNA a doppio filamento (double strand RNA, dsRNA, come i Reovirus), a singolo filamento con polarità positiva (single strand RNA+, ssRNA+ come i Paramixovirus) se il genoma è capace di funzionare da mRNA, e a singolo filamento a polarità negativa (single strand RNA-, ssRNA- come i Rhabdovirus) se per sintetizzare le proteine ha prima bisogno di essere trascritto in un filamento complementare. Inoltre esistono virus con RNA frammentato (come i Reovirus o gli Orthomyxovirus) o con due copie dello stesso filamento (HIV).
Normalmente non c’è una divisione tra geni precoci o tardivi (non ci sono early phase e late phase), e tutto il ciclo avviene nel citoplasma: viene sintetizzato RNA+ (con un passaggio in RNA- se si parte da ssRNA+) sia completo che parziale: quello completo farà da nuovo genoma, i trascritti parziali corrispondono alle varie proteine che il virus sintetizza.
C’è anche qui un’eccezione: il virus influenzale (Orthomyxovirus) ha necessità di entrare nel nucleo per la maturazione dei suoi mRNA, altrimenti privi di cap e poliA
Anche qui per l’assemblaggio non c’è una regola precisa.
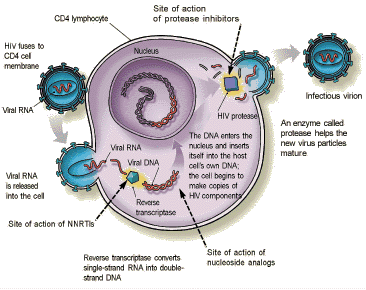
HIV
HIV fa categoria a sé: ha un genoma a RNA, ma per replicare deve sintetizzare in filamento di DNA tramite trascrizione inversa. Questo si integra del DNA cellulare e da lì comincia a sintetizzare le proteine, esattamente come il DNA cellulare.
Fuoriuscita
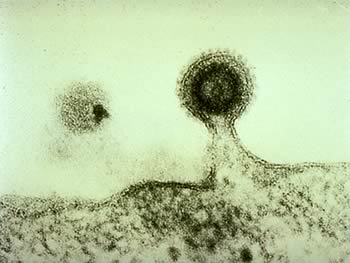
Al termine della replicazione il virus deve uscire dalla cellula. La fuoriuscita può avvenire per gemmazione (budding) o per lisi cellulare. Normalmente, se un virus ha envelope esce per gemmazione, se è nudo per lisi cellulare. Si potrebbe pensare che un’uscita per gemmazione sia meno traumatica di quella litica, ma la gravità della patologia non dipende da questo, basti pensare che il virus Ebola esce per gemmazione.
Tags:
adsorbimento,
budding,
dsRNA,
early phase,
gemmazione,
late phase,
lisi,
ssRNA
12 maggio 2008 - 12:17 pm
Forse questo post avrebbe dovuto essere tra i primissimi, però meglio tardi che mai. Mi ricordo di aver letto su un testo di patologia questa definizione: un virus è una brutta notizia avvolta in una proteina. In effetti quando si parla di virus si parla sempre di brutte – o pessime – notizie: sono organismi talmente semplici da essere sulla linea di confine tra la materia vivente e la materia non vivente, talmente poveri strutturalmente da aver bisogno dell’aiuto di una cellula ospite per riprodursi, sono perciò patogeni obbligati. In quanto tali, non stupisce che causino malattia, a volte lieve, a volte molto grave: ecco il perché della brutta notizia. La seconda parte della definizione fa riferimento alla struttura comune a tutti i virus: uno strato proteico che ricopre il genoma. Molti virus si limitano a questa struttura, altri aggiungono strati aggiuntivi, quasi sempre formati da fosfolipidi. Andiamo con ordine e cominciamo con la storia.
Storia della virologia
La prima volta che si è cercato di contrastare un’infezione virale è stata quando, nel 1796, Edward Jenner cominciò la sua campagna di vacinazione contro il vaiolo. Dell’esperimento ne abbiamo già parlato (nel post sui vaccini), c’è però da dire che allora non si aveva idea di cosa fosse un virus. Questo fu un primo tentativo empirico, che per fortuna risultò enormemente valido. Tanto che Pasteur, un secolo dopo, chiamò la sua procedura vaccinazione, in onore agli esperimenti di Jenner. Egli coniò anche il termine Virus, prendendo la parola dal latino (veleno). Da quel momento ci fu un’impennata di conoscenza sui virus: si isolarono i corpi inclusi dalle infezioni di vaiolo, successivamente si scoprì che esisteva un agente infettivo filtrabile, più piccolo di qualunque batterio conosciuto: il virus del mosaico del tabacco (TMV).
Nel 1900 venne dimostrato che la febbre gialla era trasmessa dalle zanzare e, nel 1911, Rous dimostrò che alcuni virus causavano tumore. Si diede un senso al detto “anche le pulci hanno le pulci” quando, nel 1915, si scoprì che alcuni virus possono infettare dei batteri. Questa scoperta diede uno slancio enorme nella ricerca in virologia, perché dava l’opportunità di lavorare praticamente senza rischi.
Nel 1940 finalmente la prima foto: veniva fotografato il TMV al microscopio elettronico, e nel 1952 Harshey e Chase dimostrarono, con l’uso di un batteriofago, che il codice genetico risiede nel DNA e non nelle proteine.
Oggi le conoscenze sono moltissime, la struttura dei virus, la loro biologia molecolare e la loro biochimica sono conosciuti molto bene, ma è ovvio che queste prime scoperte furono fondamentali, come è anche ovvio che le conoscenze di oggi sono ancora limitate e migliorabili. La storia della virologia è costellata di grandi scoperte (alcune da premio Nobel) e da grandi abbagli (come quando si credeva che il kuru, malattia prionica, fosse data da un virus). Ma questo credo sia comune un po’ a tutta la biologia.
Struttura
Esistono virus di tutti i tipi: piccoli o molto grandi, allungati, a forma di mattone o proiettile, rotondi, icosaedrici… Le dimensioni variano da 18 a 700 nm di diametro (anche se esistono i filovirus, con particella allungata, la cui lunghezza può arrivare ad 1 μm) e contengono un solo tipo di acido nucleico: esistono infatti virus a DNA e virus a RNA.
Il capside

Il genoma dei virus è di norma costituito da una catena di acido nucleico, che può essere DNA o RNA, a seconda del tipo di virus, ed è normalmente contenuto in una struttura proteica chiamata capside. Il capside proteico può avere diverse forme: elicoidale, icosaedrico, complesso (come nei fagi T pari o il capside a mattone del Poxvirus). Quando il virus è nudo, il capside è l’unico rivestimento della particella. In questo caso presenta le proteine necessarie per il riconoscimento recettoriale indispensabile per l’infezione (spikes o spicole).
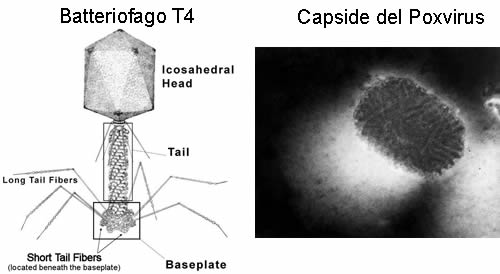
Molti virus hanno invece un secondo rivestimento, proveniente dalla membrana cellulare della cellula ospite, e formato da fosfolipidi. Questo secondo rivestimento è chiamato envelope, su cui sono evidenti le spikes necessarie per l’infezione, che non fanno parte del capside ma che sono vere e proprie proteine di membrana, spesso glicoproteine. Esistono poi altri tipi di proteine necessarie all’infezione, si va dalle proteine importanti per la fusione delle membrane a quelle emoagglutinanti, l’importante è capire che comunque tutte sono indispensabili al virus: in una struttura piccola ed essenziale come quella virale non c’è spazio per strutture inefficenti. Nei virus con envelope, il capside e il genoma virale sono spesso chiamati con l’unico nome di nucleocapside, mentre il capside è spesso chiamato core.
Esistono poi, nei virus con envelope, delle proteine con funzione strutturale, situate proprio al di sotto dello strato fosfolipidico, chiamate proteine di matrice o proteine M.
Infine, alcuni virus portano con se degli enzimi: HIV ha al suo interno la trascrittasi inversa e l’integrasi, ma nei virus possono trovarcisi anche polimerasi, o complessi importanti per la maturazione dell’RNA. Nessuno di loro però ha ribosomi, o meccanismi metabolici per produrre ATP, quindi nessuno di loro è autosufficiente, sono quindi parassiti obbligati.
Tags:
capside,
core,
envelope,
spicole,
virus nudo
 Tossine neurotrope
Tossine neurotrope


 Scusate l’assenza, la spiegazione delle tossine batteriche riprenderà presto, ora voglio parlare di Influenza suina. Qualunque altro intervento nei commenti è bene accetto: correzioni, aggiunte, domande e risposte.
Scusate l’assenza, la spiegazione delle tossine batteriche riprenderà presto, ora voglio parlare di Influenza suina. Qualunque altro intervento nei commenti è bene accetto: correzioni, aggiunte, domande e risposte.


 La trasformazione è, nelle cellule eucariotiche, quel complesso processo che, passaggio dopo passaggio, porta alla nascita di cellule incapaci di inibizione da contatto, in continua proliferazione e sempre più indifferenziate: le cellule tumorali. Ci sono infinite cause della trasformazione cellulare: lo smog cittadino, il fumo, agenti chimici comuni quali ad esempio l’asbesto, l’alimentazione ricca di carne… tutte queste cause, e molte altre, hanno in comune la capacità di interferire con il DNA o con il ciclo cellulare, cambiando il normale svolgimento dei processi di replicazione e mitosi (o anche interferendo con l’apoptosi), oppure dannegiando fisicamente l’acido nucleico. Esistono molti virus che interagendo con il ciclo cellulare o con il DNA riescono a causare tumori: il più famoso, quello che è balzato agli onori della cronaca nell’ultimo anno, è il papillomavirus umano (HPV), riconosciuto come causa unica del cancro alla cervice uterina. Piccola curiosità per quelli che fanno colture cellulari in laboratorio: le cellule HeLa sono cellule di cancro alla cervice, quindi hanno integrato parti del genoma di HPV (rif:
La trasformazione è, nelle cellule eucariotiche, quel complesso processo che, passaggio dopo passaggio, porta alla nascita di cellule incapaci di inibizione da contatto, in continua proliferazione e sempre più indifferenziate: le cellule tumorali. Ci sono infinite cause della trasformazione cellulare: lo smog cittadino, il fumo, agenti chimici comuni quali ad esempio l’asbesto, l’alimentazione ricca di carne… tutte queste cause, e molte altre, hanno in comune la capacità di interferire con il DNA o con il ciclo cellulare, cambiando il normale svolgimento dei processi di replicazione e mitosi (o anche interferendo con l’apoptosi), oppure dannegiando fisicamente l’acido nucleico. Esistono molti virus che interagendo con il ciclo cellulare o con il DNA riescono a causare tumori: il più famoso, quello che è balzato agli onori della cronaca nell’ultimo anno, è il papillomavirus umano (HPV), riconosciuto come causa unica del cancro alla cervice uterina. Piccola curiosità per quelli che fanno colture cellulari in laboratorio: le cellule HeLa sono cellule di cancro alla cervice, quindi hanno integrato parti del genoma di HPV (rif:  Sono i più numerosi, tra i virus capaci di trasformazione ricordiamo gli Hepadnavirus (HBV), gli Herpesvirus (Epstein-Barr, EBV, e Human Herpesvirus 8, HHV8) e quelli che una volta venivano chiamati PaPoVA (Papilloma, Polyoma e Vacuolating Agents).
Sono i più numerosi, tra i virus capaci di trasformazione ricordiamo gli Hepadnavirus (HBV), gli Herpesvirus (Epstein-Barr, EBV, e Human Herpesvirus 8, HHV8) e quelli che una volta venivano chiamati PaPoVA (Papilloma, Polyoma e Vacuolating Agents). Sono tutti retrovirus, e nell’uomo il più comune è lo Human T-cell Leukemia Virus (HTLV-1 e HTLV-2), e come dice il nome, causa leucemie. Tutti i retrovirus che causano tumore sono chiamati Oncovirus e possono agire in tre modi
Sono tutti retrovirus, e nell’uomo il più comune è lo Human T-cell Leukemia Virus (HTLV-1 e HTLV-2), e come dice il nome, causa leucemie. Tutti i retrovirus che causano tumore sono chiamati Oncovirus e possono agire in tre modi

 La prima cosa che un virus fa è prendere contatto con la superficie cellulare. L’adsorbimento virale avviene quando il virus lega il suo recettore tramite le spicole. Una volta legato il recettore, comincia la fase di penetrazione. Esistono vari tipi di penetrazione: la maggior parte dei fagi, ad esempio, inocula il genoma all’interno del batterio, lasciando all’esterno le proteine del capside (nei fagi T pari, ad esempio, avviene un processo che sembra una vera e propria iniezione, con la parte elicoidale del capside che si contrae nel momento di inoculo del DNA), quasi tutti i virus umani invece entrano con il capside (o nucleocapside) intatto e, se esiste l’envelope, questo si fonde con la membrana cellulare, altrimenti il virus può entrare stimolando l’endocitosi mediata dalla clatrina cellulare. In ogni caso, il processo replicativo inizia solo quando il virus è dentro la cellula: lo ripeto ancora una volta, nessun virus può replicare al di fuori della cellula bersaglio.
La prima cosa che un virus fa è prendere contatto con la superficie cellulare. L’adsorbimento virale avviene quando il virus lega il suo recettore tramite le spicole. Una volta legato il recettore, comincia la fase di penetrazione. Esistono vari tipi di penetrazione: la maggior parte dei fagi, ad esempio, inocula il genoma all’interno del batterio, lasciando all’esterno le proteine del capside (nei fagi T pari, ad esempio, avviene un processo che sembra una vera e propria iniezione, con la parte elicoidale del capside che si contrae nel momento di inoculo del DNA), quasi tutti i virus umani invece entrano con il capside (o nucleocapside) intatto e, se esiste l’envelope, questo si fonde con la membrana cellulare, altrimenti il virus può entrare stimolando l’endocitosi mediata dalla clatrina cellulare. In ogni caso, il processo replicativo inizia solo quando il virus è dentro la cellula: lo ripeto ancora una volta, nessun virus può replicare al di fuori della cellula bersaglio.


