Per ottenere un gene devo partire da un tessuto, un
organo o un ammasso di cellule, da questi posso avere tre cose:
. DNA,
. RNA totali (da cui posso ricavare l'RNA messagero),
. proteine totali (proteina purificata x -tramite uso di anticorpi
per il suo riconoscimento-).
Conoscendo le zone fiancheggianti al gene di interesse posso costruirmi
un oligonucleotide e isolare il mio gene. Posso anche derivarlo
partendo dal gene omologo a quello cercato, ma presente (e identificato)
su un'altra specie: la PCR sarà svolta in condizioni non troppo
strette di annealing.
Volendo posso però costruirmi delle banche, o delle genoteche: ossia
avere tutta una serie di cloni ricombinanti che sono rappresentativi
dell'intero genoma di un certo organismo, in questo modo ho tutto
il genoma di un organismo clonato in opportuni vettori.
Una volta che ho trasformato E.coli, e ho il materiale su cui lavorare,
un po' di colonie trasformate contenenti il gene clonato le uso
per caratterizzare il gene (screening) e in parte amplifico la cultura
e la conservo a -80°C (storage).
Esistono banche genomiche e banche a cDNA. La loro differenza fondamentale
consiste nella presenza di introni (sequenze che durante la maturazione
dell'mRNA eucariote vengono perse) ed altre sequenze non mantenute
una volta ottenuto l'mRNA maturo. Elementi come promotori, sequenze
leader, trailer sono ritrovabili sono nelle banche genomiche.
Questa diversità è spiegabile in seguito alla realizazzione
delle banche: frammentantando l'intero genoma nelle banche genomiche
o utilizzando gli mRNA (poi convertiti in cDNA) per le banche
a cDNA.
Per allestire le librerie genomiche parto dalle
cellule e arrivo alla scelta del vettore (in funzione della dimensione
dei frammenti genici), estraggo il DNA e lo digerisco (così com'è
non può essere clonato 108bp!), stando attento che la
banca che vado a costruire sia rappresentativa di tutto il genoma,
frammentando il meno possibile tra i geni (digestioni parziali seriali).
Una volta che l'ho digerito posso o clonarlo tutto o selezionare
solo frammenti di alcune dimensioni (size fractionation). Quindi
clono il tutto.
Passando attraverso il cDNA non ho più una rappresentitività
numerica dei geni della cellula (quanti sono), ma ho un'altra informazione:
certi geni sono espressi più di altri, e questi saranno amplificati
di più, a seconda del tessuto e delle condizioni originarie del
tessuto prima che arrivasse in laboratorio.
Per screenare le banche ci sono diversi metodi, il punto di partenza
è che devo avere una sonda specifica per quello che vado a marcare.
In entrambi i casi io arrivo all'isolamento del gene. Nel caso in
cui avessi solo la proteina purificata esistono metodi di sequenziamento
delle proteine da cui posso costruirmi un gene sintetico, tenendo
conto di tutti i fattori (sonde di Guessmer: oligo sonda di circa
20nucleotidi - circa 7 amminoacidi- che tiene conto del codice degenerato,
scegliendo una regione proteica che contenga il numero minimo di
codoni degenerati ), oppure posso farmi degli anticorpi, che mi
servono per screenare le banche
ad espressione.
Ottenuto il gene, lo sequenzio e ci posso fare tutti gli studi
che voglio: studiare il 3', studiare il 5', studiare com'è regolato
durante il ciclo, studiare quando è espresso, ecc., con vari passaggi
diversi a seconda del tipo di biotecnologia (industriale, farmaceutica.).
In tutti i casi quello che interessa a tutti è, dopo aver isolato
il gene, produrre in grosse quantità la proteina (così la purifico
bene e la studio) e a seconda del prodotto potrò avere trials clinici
o processi migliorativi industriali.
E' ovvio che nella banca a cDNA non devo frammentare i messaggeri!
In questi casi i cDNA non hanno estremità con siti di restrizione,
quindi devo aggiungo dei linker (un po' come la PCR),
ma prima di fare questo devo metilare il cDNA, altrimenti mi si
spezzetta tutto, infatti io non conosco la sequenza e non conosco
la mappa di restrizione.
Una volta clonati o trasformo E.coli coi plasmidi o faccio il packaging
con i fagi.
Il passaggio successivo è la caratterizzazione
della banca: devo sapere veramente cosa c'è nei miei vettori percui
una volta trasformato estraggo il DNA ricombinante da E.coli e lo
caratterizzo (ottengo la mappa di restrizione per avere un'indicazione
delle dimensioni).
Ora devo titolare la banca: devo sapere, usando un certo quantitativo
di dna e di cellule di E.coli quanti cloni ricombinanti ottengo (devo
sapere la resa). Perché devo sapere quando screeno un gene quanti
cloni ricombinanti devo analizzare per essere sicuro di trovare
il gene che più mi interessa (più il genoma è complesso più ho cloni
da analizzare) e per avere la probabilità dalla mia parte ne analizzarò
un po' di più. Questo vale anche per i frammenti: più sono piccoli
e più analisi devo fare.
Ora da una parte faccio lo screening, dall'altro lo storage (con
tanto di amplificazione di quello che mi rimane: se ho fagi, ne
uso un po' per trasformare E.coli, se ho i plasmidi, faccio crescere
E.coli, piastro , raccolgo e metto via), In questii passaggi di amplificazione
devo pure tener conto del fatto che i geni esogeni potrebbero essere
tossici per l'ospite. Magari al primo passaggio l'ospite conserva
l'esoDNA, ma successivamente tende a perderlo. Devo stare molto
attento: potrei arricchire certi geni o perderli.
C'è una formula, derivata dalla legge di Poisson, che mi permette
di calcolare il n° di cloni che io devo analizzare per avere una
certa probabilità di trovare il gene di mio interesse. Il numero
di cloni da analizzare cresce con:
1. la probabilità che io voglio di trovare il gene di mio interesse;
2. la complessità del genoma dell'organismo di cui ha fatto la banca;
3. la piccolezza dei frammenti di DNA clonati nell'organismo ospite
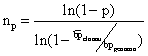 Nel
caso del genoma umano (3x109 bp), ammettendo di avere
dimensioni medie dei frammenti clonati 2x104, e ammettendo
di volrere la probabilità del 90% di trovare il frammento x, il
risultato è che io devo screenare almeno 690.000 cloni, isolati
ed indipendenti. Immaginare un po' quante piastre bisogna preparare!
Nel
caso del genoma umano (3x109 bp), ammettendo di avere
dimensioni medie dei frammenti clonati 2x104, e ammettendo
di volrere la probabilità del 90% di trovare il frammento x, il
risultato è che io devo screenare almeno 690.000 cloni, isolati
ed indipendenti. Immaginare un po' quante piastre bisogna preparare!
C'è pure una formula un po' più veloce ed empirica: il numero di
cloni da saggiare è uguale a 5 per il rapporto fra le dimensioni
del genoma e le dimensioni dei frammenti.
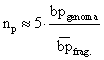 Devo
costruire la mia banca cercando di rappresentare tutto il genoma.
La miscela deve essere casuale(metodo non riproducibile), quindi
non devo tagliare favorendo frammenti grandi o piccoli, ed inoltre
devo donar loro estremità coesive. Uso allora enzimi di restrizione
di tipoII. Questi enzimi riconoscono 4, 6, 8, n bp, se ne uso uno
da n, mi darà 4n paia di basi per frammento. Teniamo
conto che non devono essere troppo piccolo e che i vettori hanno
un limite.
Devo
costruire la mia banca cercando di rappresentare tutto il genoma.
La miscela deve essere casuale(metodo non riproducibile), quindi
non devo tagliare favorendo frammenti grandi o piccoli, ed inoltre
devo donar loro estremità coesive. Uso allora enzimi di restrizione
di tipoII. Questi enzimi riconoscono 4, 6, 8, n bp, se ne uso uno
da n, mi darà 4n paia di basi per frammento. Teniamo
conto che non devono essere troppo piccolo e che i vettori hanno
un limite.
In genere si preferiscono quelli che riconoscono 4 bp con digestioni
parziali (la parziale è necessaria), inoltre mi dà una distruibuzione
più casuale (ho più possibilità di configurazione). Se facessi digestioni
totali taglierei pezzetti di un gene in cloni diversi, e come faccio
a ricostruire il tutto? Invece con le parziali posso fare il "chromosome
walking": tutti i siti non verranno tagliati con la stessa velocità
(uso [limitanti] o scarsità di tempo), il tutto è molto riproducibile,
perché il taglio dipende dall'intorno del sito di restrizione (-->
overlapping), che è sempre lo stesso.
Chromosome Walking
Impiega un fago ricombinante dal quale isolare un altro fago che
contenga informazioni relative al genoma sovrapponibili (overlap).
Basta preparare due sonde derivate una dall’estremo 5’
e l’altra dall’estremo 3’ di questo primo E.coli
e ripetere con queste sonde lo screening della genoteca.
Si otterranno altri cloni.
Se ne sceglieranno due tra quelli diversi dal primo, uno più
spostato al 3’; l’altro più spostato al 5’.
Dal clone “3’” si prepara una sonda presente al
suo estremo 3’, e dal clone 5’ una sonda presente al
suo 5’. e pronti per un altro screening e così via,
camminando sul cromosoma.
Limiti. I piccoli segmenti di DNA utilizzati per vagliare di nuovo
la genoteca devono essere rappresentati una sola volta nel genoma:
ci sono problemi col DNA ripetuto, il rischio è di saltare
da un cromosoma all’altro.
