11 aprile 2008 - 12:47 pm
Come abbiamo già detto in passati post i neuroni comunicano tra loro grazie alla generazione di “scariche elettriche”, chiamate potenziali d’azione. E’ quindi interessante avere la possibilità di generare artificialmente dei potenziali d’azione per studiare le proprietà di un certo neurone o di un network di neuroni. Ad esempio uno può stimolare il neurone 1 e vedere cosa succede al neurone 2 che vi è collegato.
Il classico approccio per fare ciò è utilizzare un elettrodo (un piccolo filamento di argento) inserito in una micropipetta di vetro dalla punta di pochi millesimi di millimetro di diametro e riempita di una soluzione conduttrice. Questo microelettrodo viene messo a contatto con la cellula (rompendone o meno la membrana a seconda del tipo di esperimento) e permette di iniettare con precisione corrente nella cellula, oltre a poterne rilevare l’attività elettrica spontanea.
Esistono però diversi altri approcci per eccitare o inibire un neurone che non richiedono l’utilizzo di un microelettrodo. I vantaggi di non usare microelettrodi sono molteplici, ma i principali sono: 1) andare a piazzare la minuscola punta dell’elettrodo sulla membrana cellulare non è proprio la cosa più semplice del mondo… 2) non si va a disturbare meccanicamente la cellula 3) sono più alla moda oggigiorno, tanto che qualcuno ne parla in un blog 
Uno di questi metodi è quello di utilizzare un neurotrasmettitore come, ad esempio, il glutamato. Possiamo “spruzzare” una piccola quantità di glutamato sulla cellula e questa, nella maggior parte dei casi, verrà eccitata. Esistono molte variazioni sul tema, ma oggi vi parlerò di un nuovo lavoro, apparso su Nature Methods di questo mese, che ha introdotto un nuovo interessante approccio.
Il lavoro in questione è il seguente: Photochemical control of endogenous ion channels and cellular excitability. – Fortin et al. – Nat. Methods 2008 Apr;5(4):331-8.
Gli autori hanno generato un “photoswitchable affinity label” (PAL), una piccola molecola che si lega selettivamente a canali sulla membrana del neurone che fanno passare gli ioni potassio (K+). In particolare, questa molecola lega un tipo di canali per il potassio (voltage-gated potassium channels) che sono sensibili a variazioni di voltaggio nella cellula. La normale funzione di questi canali è quella di riportare la cellula allo stato basale dopo la generazione di un potenziale d’azione. Insomma hanno un effetto “calmante” sull’attività cellulare.
PAL può legarsi selettivamente a questi canali e bloccarli, impedendo così il passaggio di potassio, risultando quindi in un eccitazione della cellula. La cosa interessante è che PAL è “photoswitchable”, cioè può essere “accesa” o “spenta” utilizzando luce di colori differenti. Questo è dovuto al fatto che PAL può cambiare forma quando viene colpita da luce di un certo colore: utilizzando luce viola PAL non blocca il canale, utilizzando luce verde lo blocca.
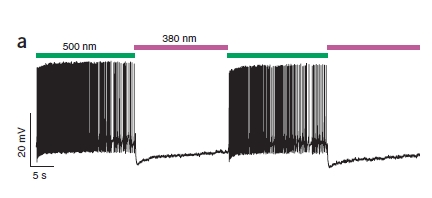
Il risultato è facilmente visualizzabile in questa figura:
Come vedete, quando la cellula è colpita da luce verde è iperattiva (ogni linea verticale rappresenta un potenziale d’azione, in alcune parti sono così fitti da non poterli distinguere) perchè PAL sta bloccando i canali al K+, mentre la luce viola silenzia la cellula.
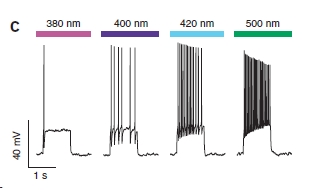
E non è finita così! Il funzionamento è graduale, quindi utilizzando luce di colore intermedio si ottiene una parziale eccitazione della cellula.
Certo, tutto questo è stato fatto su cellule in coltura ma sarebbe molto interessante vedere questo tipo di tecniche utilizzate in vivo (non dubito che ci si arriverà presto…). Ovviamente lo stesso principio potrebbe essere applicato a qualsiasi altro canale sui neuroni, si tratterà solo di sintetizzare molecole specifiche che permettano di legarsi ad altri canali!
Tags:
Attività neuronale,
Canali voltaggio dipendenti,
Elettrofisiologia,
Firing,
Imaging,
Neuroscienze,
Potenziali d'azione
7 gennaio 2008 - 3:20 pm
Uno dei motivi per cui leggo spesso le riviste con altissimo impact factor è la speranza di trovare un articolo davvero rivoluzionario che possa chiarire un determiato meccanismo oppure possa aprire la strada verso nuove prospettive, oltre che per aggiornarmi sulle recenti scoperte. Purtroppo devo dire che le riviste scientifiche più importanti alla fine non pubblicano sempre cose drasticamente innovative o chiarificatrici, anzi a volte le riviste un po’ più modeste contengono articoli con informazioni molto più convincenti e serie rispetto a Nature, Cell, Neuron etc.
In una di queste letture, mi è capitato di leggere qualcosa su Cell che, a mio avviso, è veramente incredibile, oltre che curioso. L’articolo in questione tratta di un canale del calcio voltaggio dipendente (Cav1.2) che ha anche un secondo ruolo funzionale del tutto diverso ed imprevedibile da quello che ci si aspetterebbe da un semplice canale.
Prima di entrare nel merito bisognerebbe introdurre il concetto di canale voltaggio dipendente oramai acquisito da tanti anni nel campo delle neuroscienze ma che per i non addetti ai lavori potrebbe sembrare fuorviante.
Diciamo che almeno qualche migliaio dei circa 30.000 geni umani codificano per proteine di membrana che possono formare dei canali idrofilici attraverso cui, in particolari condizioni, possono passare degli ioni. Il motivo per cui esistono tante proteine non è dovuto alla presenza tanti tipi di ioni da far passare, ma dalla fine regolazione a cui questi canali devono rispondere. La quasi totalità di questi canali ionici sono sempre chiusi, ma possono aprirsi in determinate condizioni secondo una cinetica caratteristica che è dipendente dai componenti da cui è formato.
Alcuni canali possono aprirsi solamente in seguito al legame di un neurotrasmettitore sulla regione esterna, o interna, del complesso proteico (Recettori canale), come avvine per il recettore nicotinico che fa entrare sodio all’interno della cellula in seguito al legame dell’acetilcolina con la parte esterna del recettore; la cinetica di apertura/chiusura o l’affinità con l’agonista recettoriale dipende dai componenti del canale stesso. Ovviamente l’ingresso di sodio che ne scaturisce provoca a sua volta l’attivazione di una serie di altri meccanismi a cascata come le tessere del domino che portano all’attivazione di altri effettori. Altri canali possono invece aprirsi in seguito al cambiamento delle condizioni cellulari, variazione di pH (es ASICs), di concentrazioni ioniche (es Connessine) oppure del potenziale di membrana (es canali voltaggio dipendenti).
Ogni tipo cellulare possiede il proprio corredo di recettori canale, canali voltaggio dipendenti, canali passivi e trasportatori; l’insieme di tali complessi proteici con caratteristiche finemente diverse tra loro determina delle differenze macroscopiche e microscopiche nella reattività cellulare, forma del potenziale d’azione, velocità di risposta ad uno stimolo, eccitabilità di membrana, potenziale di membrana a riposo, picco di depolarizzazione e tantissime altre variabili che fanno di un neurone un sottotipo cellulare unico. Non entro nel dettaglio di quanti canali del calcio voltaggio dipendenti esistono, dico solo che sono identificate in varie classi con la sigla Cav seguita da un numero che identifica la classe seguito da un punto e poi un altro numero che identifica il sottotipo. Tutti questi canali regolano direttamente o indirettamente tante funzioni neuronali, come la memoria, il dolore, l’eccitabilità, la fertilità e la sensibilità a determinati danni patologici. Tuttavia è noto anche che questi canali ionici possono avere anche una funzione nella regolazione della trascrizione genica, poiché molti fattori trascrizionali sono regolati dalle concentrazioni di determinati ioni come ad esempio il calcio. Questa è stata sempre una teoria debole, poiché indubbiamente ci sono dei casi in cui l’effetto sulla trascrizione genica può essere drasticamente diverso se si trasfettano in cellule dei canali composti da subunità diverse. Insomma se è l’ingresso di ioni calcio a determinare l’attivazione di alcuni fattori trascrizionali allora l’effetto dovrebbe essere uguale per qualsiasi canale che fa entrare calcio, soprattutto se 4 subunità su 5 sono identiche e le caratteristiche cinetiche di ingresso e uscita del calcio sono praticamente le stesse.
Tuttavia questo non avviene sempre, come ho già accennato, l’effetto può essere drasticamente diverso, tale che alcuni canali ionici possono determinare il differenziamento neuronale in alcune cellule, mentre altri canali possono determinare l’espressione di proteine del metabolismo o neurotrasmettitori in maniera non chiara.
Una spiegazione che, secondo me, ha aperto la strada e gli occhi a molti ricercatori scientifici risiede nell’articolo di cui parlavo all’inizio di questa disquisizione, pubblicato su un numero di Cell dell’anno scorso dalla dott.sa Gomez-Ospina dell’università di Stenford. Il canale del calcio voltaggio dipendente (Cav1.2) possiede nel dominio C-terminale una sequenza peptidica che, se tagliata, è di fatto un fattore trascrizionale a tutti gli effetti e modula un cospicuo gruppo di geni endogeni importanti per la neurotrasmissione e per l’eccitabilità neuronale.
Il fattore trascrizionale in questione è stato definito Fattore Trascrizionale Associato al Canale del Calcio (CCAT) e si origina mediante la proteolisi di Cav1.2. Appena liberato, questo fattore trascrizionale si localizza nel nucleo dei soli neuroni grazie a meccanismi non ancora ben chiari e lì lega proteine nucleari e sequenze specifiche di DNA attivando la trascrizione dei geni target.
La cosa curiosa è che CCAT a sua volta è regolato dalle concentrazioni di calcio e dalla presenza di altri fattori trascrizionali che variano durante lo sviluppo, quindi il suo funzionamento è regolato da diverse variabili. L’effetto finale che ha il canale Cav1.2 quindi non è semplicemente variare la concentrazione di calcio ma regolare direttamente la trascrizione di geni target.
Bhé in definitiva questo articolo ci racconta come a volte le teorie che vengono formulate e che leggiamo di continuo non siano altro che un velo oltre il quale si nascondono dei meccanismi, come in questo caso, inimmaginabili e forse anche al limite della credibilità secondo le attuali conoscenze molecolari.
Forse non tutti i meccanismi sono di questo tipo e così semplici da spiegare, ma possiamo essere certi che c’è ancora tanto da scoprire dietro le nostre attuali teorie.
Tags:
Biologia molecolare,
Canali voltaggio dipendenti,
fattori trascrizionali,
Neuroscienze,
Potenziali d'azione
 Commenti disabilitati
Commenti disabilitati
![]()




