19 aprile 2008 - 2:02 am
Non c’è dubbio: i ricercatori amano costruire semplici e chiari modelli dei processi biologici che studiano. Tutto sembra così bello quando c’è un schemino corredato di frecce e cascate del segnale che ti chiarifica come vanno veramente le cose… o forse no? Oggi vi faccio un esempio di come a volte la situazione è un po’ più complessa (e meno perfetta) di quanto ci piacerebbe credere.
Parliamo di comunicazione neuronale: il modello classico a riguardo è quello della sinapsi. Citando da Wikipedia: “una sinapsi è una struttura altamente specializzata che consente la comunicazione tra le cellule del tessuto nervoso, i neuroni”. Quello che ciascun libro di testo vi fa vedere è che l’assone di un neurone (il neurone presinaptico) va a contattare un dendrita, il corpo cellulare o l’assone di un altro neurone (il neurone postsinaptico). In questo modo i due neuroni sono connessi e possono parlare fra di loro.
Ma come fanno esattamente? Ci sono due tipi di sinapsi : sinapsi chimiche e sinapsi elettriche. Oggi vi parlerò solo di sinapsi chimiche: non ne farò una descrizione esaustiva, quindi non prendete questo post come testo sacro… non ha nemmeno uno schemino corredato di frecce!
La sinapsi chimica in breve funziona così: il neurone presinaptico viene in qualche modo attivato, non ci interessa come al momento. Questo provoca la generazione di potenziali d’azione (e su dove esattamente questi potenziali d’azione siano generati si potrebbero spendere pagine…) che possono viaggiare sull’assone ed arrivare al terminale, dove abbiamo la nostra sinapsi chimica. Il terminale del neurone è pieno di piccole strutture chiamate vescicole, e piene di una o più determinate sostanze chimiche dette neurotrasmettitori. Quando i potenziali d’azione arrivano al terminale, facilitano l’entrata di calcio nel neurone presinaptico e ciò permette la fusione delle vescicole con la membrana sinaptica ed il rilascio del loro contenuto all’esterno. Il neurotrasmettitore potrà poi legarsi ad opportuni recettori localizzati all’interno della sinapsi sul neurone postsinaptico e attivare o inibire quest ultimo, modulandone la capacità di generare potenziali d’azione e quindi in ultima istanza di rilasciare le sue vescicole di neurotrasmettitore sul neurone successivo. Il neurotrasmettitore viene poi recuperato dai neuroni o dalla glia (l’altra grossa categoria di cellule presente nel cervello) per essere riciclato o alterntativamete distrutto.
Questa immagine, presa da questo sito, mostra una fotografia al microscopio elettronico di una sinapsi. Tutte quelle sferette che vedete sono vescicole sinaptiche che si stanno fondendo con la membrana plasmatica ad una sinapsi.

Bene, quindi è tutto semplice e funziona benissimo… beh non proprio!
Benchè questo fosse un po’ il dogma di come funziona una sinapsi, negli ultimi 15-20 anni sono state scoperti altri modi in cui il nostro cervello utilizza i neurotrasmettitori.
Innanzitutto, partirei dalla glia: la glia è sempre stata considerata come qualcosa di inerte, materiale di supporto per i neuroni. Questo è risultato essere assolutamente falso, la glia ricopre ruoli molto più complessi nel cervello ed uno di questi è proprio quello di produrre neurotrasmettitori! Non solo quindi è implicata nel riciclaggio dei neurotrasmettitori, ma può anche secernerli. Un recente studio ha addirittura mostrato che alcune cellule gliali possono generare potenziali d’azione… non esattamente materiale inerte quindi! Gli stessi trasportatori che permettono di internalizzare il neurotrasmettitore nella glia, possono funzionare al contrario in alcune situazioni ed invece di internalizzarlo lo trasportano all’esterno!
Un’altra modalità di rilascio di neurotrasmettitori è il rilascio non vescicolare: in alcuni casi infatti un po’ di neurotrasmettitore può “scappare” da un neurone senza bisogno che ci sia la fusione di una vescicola con la membrana sinaptica. Questo processo è assolutamente indipendente dai potenziali d’azione e quindi questo neurotrasmettitore viene rilasciato passivamente.
Infine quando il neurotrasmettitore viene rilasciato nello spazio sinaptico, ancora una volta un po’ ne può “scappare via” (neurotransmitter spillage) e andare all’esterno della sinapsi, in sinapsi o all’esterno di sinapsi di altri neuroni. Questo è un bellissimo esempio, a mio parere, di quanto imperfetto sia il nostro cervello, ma di come l’evoluzione ci abbia permesso di sfruttare queste imperfezioni.
Se infatti è vero che questo rilascio involontario di neurotrasmettitore può andare ad attivare altri neuroni che in teoria non avrebbero dovuto partecipare alla trasmissione di quel particolare impulso, è anche vero che il nostro cervello è in grado di sfruttare questa situazione: esistono infatti i cosiddetti recettori extrasinaptici per i neurotrasmettitori, cioè recettori localizzati al di fuori della sinapsi che possono captare queste “perdite” ed attivare segnali intracellulari. Se pensate che un metodo di comunicazione puramente basato sulla casuale perdita di una sostanza dalla sinapsi sia inefficiente e poco “smart”… beh, vi do ragione, ma sappiate che esistono cellule nel cervelletto che comunicano esclusivamente utilizzando perdite di glutamato da sinapsi vicine!
Tags:
Attività neuronale,
Firing,
Neuroscienze,
Potenziali d'azione
11 aprile 2008 - 12:47 pm
Come abbiamo già detto in passati post i neuroni comunicano tra loro grazie alla generazione di “scariche elettriche”, chiamate potenziali d’azione. E’ quindi interessante avere la possibilità di generare artificialmente dei potenziali d’azione per studiare le proprietà di un certo neurone o di un network di neuroni. Ad esempio uno può stimolare il neurone 1 e vedere cosa succede al neurone 2 che vi è collegato.
Il classico approccio per fare ciò è utilizzare un elettrodo (un piccolo filamento di argento) inserito in una micropipetta di vetro dalla punta di pochi millesimi di millimetro di diametro e riempita di una soluzione conduttrice. Questo microelettrodo viene messo a contatto con la cellula (rompendone o meno la membrana a seconda del tipo di esperimento) e permette di iniettare con precisione corrente nella cellula, oltre a poterne rilevare l’attività elettrica spontanea.
Esistono però diversi altri approcci per eccitare o inibire un neurone che non richiedono l’utilizzo di un microelettrodo. I vantaggi di non usare microelettrodi sono molteplici, ma i principali sono: 1) andare a piazzare la minuscola punta dell’elettrodo sulla membrana cellulare non è proprio la cosa più semplice del mondo… 2) non si va a disturbare meccanicamente la cellula 3) sono più alla moda oggigiorno, tanto che qualcuno ne parla in un blog 
Uno di questi metodi è quello di utilizzare un neurotrasmettitore come, ad esempio, il glutamato. Possiamo “spruzzare” una piccola quantità di glutamato sulla cellula e questa, nella maggior parte dei casi, verrà eccitata. Esistono molte variazioni sul tema, ma oggi vi parlerò di un nuovo lavoro, apparso su Nature Methods di questo mese, che ha introdotto un nuovo interessante approccio.
Il lavoro in questione è il seguente: Photochemical control of endogenous ion channels and cellular excitability. – Fortin et al. – Nat. Methods 2008 Apr;5(4):331-8.
Gli autori hanno generato un “photoswitchable affinity label” (PAL), una piccola molecola che si lega selettivamente a canali sulla membrana del neurone che fanno passare gli ioni potassio (K+). In particolare, questa molecola lega un tipo di canali per il potassio (voltage-gated potassium channels) che sono sensibili a variazioni di voltaggio nella cellula. La normale funzione di questi canali è quella di riportare la cellula allo stato basale dopo la generazione di un potenziale d’azione. Insomma hanno un effetto “calmante” sull’attività cellulare.
PAL può legarsi selettivamente a questi canali e bloccarli, impedendo così il passaggio di potassio, risultando quindi in un eccitazione della cellula. La cosa interessante è che PAL è “photoswitchable”, cioè può essere “accesa” o “spenta” utilizzando luce di colori differenti. Questo è dovuto al fatto che PAL può cambiare forma quando viene colpita da luce di un certo colore: utilizzando luce viola PAL non blocca il canale, utilizzando luce verde lo blocca.
Il risultato è facilmente visualizzabile in questa figura:
Come vedete, quando la cellula è colpita da luce verde è iperattiva (ogni linea verticale rappresenta un potenziale d’azione, in alcune parti sono così fitti da non poterli distinguere) perchè PAL sta bloccando i canali al K+, mentre la luce viola silenzia la cellula.
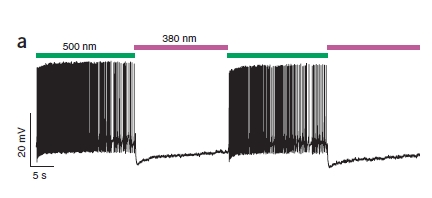
E non è finita così! Il funzionamento è graduale, quindi utilizzando luce di colore intermedio si ottiene una parziale eccitazione della cellula.
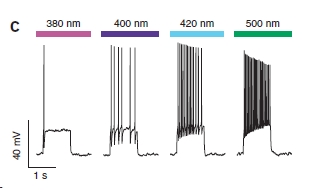
Certo, tutto questo è stato fatto su cellule in coltura ma sarebbe molto interessante vedere questo tipo di tecniche utilizzate in vivo (non dubito che ci si arriverà presto…). Ovviamente lo stesso principio potrebbe essere applicato a qualsiasi altro canale sui neuroni, si tratterà solo di sintetizzare molecole specifiche che permettano di legarsi ad altri canali!
Tags:
Attività neuronale,
Canali voltaggio dipendenti,
Elettrofisiologia,
Firing,
Imaging,
Neuroscienze,
Potenziali d'azione
6 dicembre 2007 - 9:47 pm
Come si diceva nel post di presentazione di questo blog, la bioinformatica gioca un importante ruolo nelle neuroscienze. Ho deciso quindi di scrivere questo post per tutti i nostri amici bioinformatici (e non).
Lo spunto nasce da una lettera a Nature che stavo leggendo tempo fa: Unique features of action potential initiation in cortical neurons – Nature 2006.
Premetto che l’articolo è piuttosto complesso ed entra in dettagli che credo non interessino ai più, ma quello che voglio far vedere è come sia possibile usare (nel bene o nel male, starà a voi decidere…) la bioinformatica per investigare i processi biologici del nostro cervello.
Prima di addentrarci nel problema specifico credo sia necessario fare una piccola introduzione: i neuroni nel nostro cervello comunicano fra di loro utilizzando scariche elettriche controllate, chiamate potenziali d’azione generati dal passaggio di ioni attraverso la membrana del neurone. Centinaia, se non migliaia di studi hanno analizzato nei minimi dettagli come vengano generati i potenziali d’azione, quali canali siano coinvolti, quali siano le cinetiche di questi canali e via dicendo. E qui entra in gioco la bioinformatica: se siamo in grado di usare questi dati per costruire un modello informatico di un neurone, possiamo riprodurre virtualmente un potenziale d’azione ed ottenere informazioni sul rapporto fra, per esempio, la sua forma ed i canali ionici che lo generano.
Tutto inizia con gli studi di Allan Hodgkin ed Andrew Huxley, che nel 1952 generarono il primo modello matematico di propagazione del potenziale d’azione, studio che garantì loro il premio Nobel nel 1963. Il modello di Hodgkin ed Huxley è basato su dati raccolti negli assoni giganti del calamaro e consiste di una serie di equazioni differenziali che permettono di rappresentare la generazione di un potenziale d’azione in una cellula eccitabile.
Negli ultimi 50 anni, tuttavia, questo processo è stato studiato più approfonditamente e si è venuti a scoprire che non tutti i potenziali d’azione sono uguali. L’eterogenicità è principalmente dovuta ai diversi canali espressi da diversi tipi di neuroni: giusto per fare un esempio, sono state identificate più di 100 subunità per i canali al potassio! Ciascun neurone, poi, può esprimere vari tipi di canali per lo stesso ione, quindi il numero di parametri da contare in un modello matematico diventa presto molto alto (solo per i canali di membrana si raggiungono facilmente 15 o 20 termini).
Arriviamo quindi al punto dell’articolo: gli autori hanno registrato potenziali d’azione della corteccia cerebrale in vivo ed in vitro, li hanno poi comparati con quelli generati da un modello che sfrutta le equazioni di Hodgkin ed Huxley e hanno trovato varie differenze tra la situazione sperimentale e quella derivata dal modello. In particolare la forma della fase ascendente del potenziale d’azione è differente così come il valore dell’onset potential, cioè il potenziale a cui inizia la rapida depolarizzazione della membrana, che è molto più variabile nella situazione reale che non nel modello. Questi problemi non riescono ad essere risolti semplicemente cambiando i parametri del modello, a meno di non andare ad usare valori assolutamente non fisiologici.
Queste possono sembrare piccolezze, ma non è così: i neuroni, infatti, “leggono” diversi parametri dei potenziali d’azione. La forma del potenziale d’azione può incidere ad esempio sul rilascio di neurotrasmettitori alle sinapsi e, più in generale, la forma contribuisce a generare diversi firing patterns, ossia diversi “motivi” nella generazione dei potenziali d’azione, che possono essere generati ad esempio a diverse frequenze, in continuo o in gruppi più o meno lunghi (bursts), in modo regolare o irregolare. Tutte queste variabili permettono la comunicazione di diversi stimoli da parte della stessa cellula utilizzando un solo sistema.
Gli autori dello studio propongono quindi un modello rivisto che invece modella bene le caratteristiche mancanti nel modello Hodgkin-Huxley. Il problema è che questo nuovo modello implica che i canali al sodio voltaggio-dipendenti che sono alla base della trasmissione del potenziale d’azione si aprano in modo cooperativo (cioè, l’apertura di uno favorisce l’apertura di quelli attorno). Ovviamente, non c’è alcuna prova sperimentale del fatto che ciò avvenga in un vero neurone!
Insomma, alla fin della fiera questo studio mostra come si possano derivare modelli matematici partendo dai dati sperimentali, smontare gli stessi modelli con altri dati sperimentali, per costruire così un nuovo modello che genera nuove teorie (non provate). Il prossimo passo, immagino, dovrà essere quello di accettare o smentire questo nuovo modello con altri dati sperimentali, grazie a quel magnifico processo chiamato metodo scientifico.
Tags:
Bioinformatica,
Firing,
Hodgkin & Huxley,
Modeling,
Neuroscienze,
Potenziali d'azione





