9 novembre 2010 - 7:01 pm
 …potrebbe essere colpa della “materia bianca”!
…potrebbe essere colpa della “materia bianca”!
Non è solo la corteccia cerebrale, la cosiddetta “materia grigia”, ad essere importante per le funzioni cognitive: sono sempre di più le evidenze sperimentali che mostrano come abbiano grande influenza la mielina, gli oligodendrociti e la “materia bianca” in senso più esteso. Continue Reading »
Tags:
apprendimento,
ATP,
depressione,
encefalo,
materia bianca,
mielina,
Neuroni,
oligodendrociti,
risonanza magnetica,
schizofrenia,
sonno
16 giugno 2010 - 5:25 pm
 A cosa servono gli astrociti? Negli scorsi post abbiamo cercato di rispondere a questo interrogativo esaminando due opinioni opposte. Chi dice che le cellule-stella abbiano un ruolo nei processi cognitivi superiori come apprendimento e memoria, e chi dice che queste cellule siano solo di supporto ai neuroni. Qual’è la verità? Ad oggi, non abbiamo ancora certezze. Però, esiste un possibile “modello” che spiega quanto si è finora scoperto. Continue Reading »
A cosa servono gli astrociti? Negli scorsi post abbiamo cercato di rispondere a questo interrogativo esaminando due opinioni opposte. Chi dice che le cellule-stella abbiano un ruolo nei processi cognitivi superiori come apprendimento e memoria, e chi dice che queste cellule siano solo di supporto ai neuroni. Qual’è la verità? Ad oggi, non abbiamo ancora certezze. Però, esiste un possibile “modello” che spiega quanto si è finora scoperto. Continue Reading »
Tags:
apprendimento,
Astrociti,
Calcio,
Cellule-stella,
IP3,
Memoria,
Neuroni,
transient receptor potential
31 maggio 2010 - 7:32 pm
 Memoria, apprendimento… Meccanismi ben lontani dall’essere svelati. I neuroni, fino a pochi anni fa dominatori indiscussi della scena, stanno dividendo le luci della ribalta con qualcuno che potrebbe togliere loro il ruolo di protagonisti nei fenomeni neurologici: gli astrociti. Le ormai famose cellule-stella sono al centro di una diatriba: c’è chi sostiene un loro ruolo nella comunicazione tra neuroni e chi al contrario vorrebbe continuare a considerare queste cellule come “assistenti” che aiutano le cellule neuronali a vivere ben nutrite.
Memoria, apprendimento… Meccanismi ben lontani dall’essere svelati. I neuroni, fino a pochi anni fa dominatori indiscussi della scena, stanno dividendo le luci della ribalta con qualcuno che potrebbe togliere loro il ruolo di protagonisti nei fenomeni neurologici: gli astrociti. Le ormai famose cellule-stella sono al centro di una diatriba: c’è chi sostiene un loro ruolo nella comunicazione tra neuroni e chi al contrario vorrebbe continuare a considerare queste cellule come “assistenti” che aiutano le cellule neuronali a vivere ben nutrite.
Quale sarà la giusta soluzione? Continue Reading »
Tags:
Astrociti,
Calcio,
Cellule-stella,
GPCR,
IP3,
Memoria,
Neuroni,
plasticità neuronale,
recettori,
sinapsi
31 maggio 2010 - 10:29 am
Gli 007 del Sistema Nervoso Centrale
Preambolo
Eccoci di nuovo con il seguito del nostro giallo misterioso, ed iniziamo subito con un breve riassunto.
Siamo nei panni di un improbabile investigatore molecolare che deve scoprire chi ha causato la morte dei neuroni in seguito ad ictus. Nelle prime puntate abbiamo appreso la complessità dell’evento ischemico, ciò che ne consegue, e la volontà preprogrammata di qualcuno di assassinare i neuroni. Nella puntata precedente, invece, abbiamo introdotto le cellule microgliali che rappresentano delle guardie giurate dedicate alla protezione del cervello. Oggi vedremo come queste cellule siano più simili a degli agenti segreti.
L’interrogatorio
Per istituire un processo contro qualcuno é necessario avere delle prove convincenti; i sospetti da soli non bastano.
Ecco i fatti:
- Il cervello si trova in una condizione isolata, prima, durante e dopo il neuroomicidio;
- C’è sicuramente un colpevole e deve necessariamente essere contenuto all’interno del cervello;
- In questa ‘stanza’ troviamo permanentemente i neuroni (le principali vittime), la glia (vittime collaterali), e la microglia (guardie giurate);
- La microglia, il terzo incomodo, sopravvive al danno e si allontana dai neuroni poco prima che muoiano;
- La microglia in opportune condizioni riesce ad uccidere le cellule patogene ed anche i neuroni in agonia;
- La microglia non ha ancora un alibi per l’evento ischemico.
Continuiamo quindi l’interrogatorio nei confronti della microglia.

“…in altre parole i neuroni sono morti poco dopo la sua visita?”
“Sì, ma ero già lontano quando questo è successo”
“Può spiegarci perché Lei si è allontanato dal danno neuronale salvandosi la pelle, invece che combattere fino all’ultimo respiro? Dopotutto questo è il Suo ruolo, Lei è una guardia giurata e non può allontanarsi quando le cose vanno male”
“In realtà c’era ben poco da fare quando sono arrivato sul luogo del delitto, i neuroni stavano già morendo, non ho potuto far nulla ed era inutile sacrificarsi. Noi cellule microgliali non abbiamo alcuna possibilità di rinforzo da parte di progenitori esterni alla BEE, quindi sacrificarsi durante l’ischemia avrebbe comportato una perdita di cellule con una conseguente perdita di protezione per gli altri neuroni ancora vivi.”
“…uhmm… se ho capito bene, Lei è arrivato in ritardo, non ha fatto nulla e si è allontanato quando le cose si sono messe male. Perchè?”
“Sono preparato per affrontare cellule patogene, infezioni, infiammazioni ed eventi simili. L’evoluzione non mi ha selezionato per affrontare l’assenza di ossigeno e nutrienti.”
“…e cosa ha fatto in quei brevi momenti in cui Lei era a contatto con tanti neuroni poco prima che morissero?”
“Ho liberato dei fattori trofici per sostenere i neuroni e la glia. Generalmente i neuroni sono meno sensibili alla morte quando ricevono degli ormoni. Il mio ruolo era quello di incoraggiarli a vivere fino a quando fosse possibile”
Sembra non esserci nulla di serio, ma il dubbio rimane; ad esempio come mai una cellula tanto efficiente nel riconoscere i danni neuronali si è accorta del danno in corso così tanto in ritardo e non abbia potuto far nulla? La morte neuronale sembra avvenire poco dopo la scomparsa della microglia, può essere tutto questo un caso?
La ricostruzione del delitto
 Prima di trarre conclusioni affrettate andiamo in laboratorio con la nostra ricostruzione della scena del crimine. Induciamo una ischemia cerebrale a dei ratti ed analizziamo nel tempo cosa fa la microglia nel SNC. Anche se non è facile seguire le cellule microgliali che girano nel cervello quando l’animale è vivo, è possibile ricostruire la scena mettendo insieme una serie di animali analizzati a tempi diversi dopo l’evento ischemico.
Prima di trarre conclusioni affrettate andiamo in laboratorio con la nostra ricostruzione della scena del crimine. Induciamo una ischemia cerebrale a dei ratti ed analizziamo nel tempo cosa fa la microglia nel SNC. Anche se non è facile seguire le cellule microgliali che girano nel cervello quando l’animale è vivo, è possibile ricostruire la scena mettendo insieme una serie di animali analizzati a tempi diversi dopo l’evento ischemico.
Qui la prima sorpresa. Nel SNC tutte le cellule neuronali e astrocitarie sono pressoché fisse, magari con una mobilità molto limitata e lenta, mentre le cellule microgliali si muovono ad una velocità impressionante. Quello che colpisce molto è la capacità di attraversare reti di assoni, di dendrociti, cellule neuronali ed astrocitarie senza causare danno e senza avere punti di appiglio.
La seconda sorpresa è ancora più scioccante, la forma, le dimensioni e le caratteristiche di queste cellule è enormemente vasta, difficile riconoscerle anche per un occhio esperto. Si possono definire almeno 7 fenotipi principali di microglia: ameboide, ramificata, attiva e non fagocitica, attiva e fagocitica, cellule del composto granulare, perivascolare e juxatavascolare.
Neanche uno 007 potrebbe possedere altrettante identità. Per seguirle, quindi, possiamo usare dei markers, generici come Iba-1 o RCA-1 per riconoscere un po’ tutte le identità microgliali, oppure selettivi come ED1 per riconoscere solo le cellule microgliali attivate. Vi renderete subito conto della complessità di tale analisi, poiché nessun marker fino ad ora scoperto è effettivamente in grado di riconoscere tutte le identità microgliali in maniera specifica e selettiva. Insomma queste cellule sono qualcosa di sfuggente come potrebbe essere un agente segreto.
Ad aggiungere ulteriori sospetti c’è il fatto che le cellule microgliali si avvicinano ai neuroni con una certa identità e se ne allontanano con un’altra. Se poi pensiamo di fare una perquisizione e cercare cosa trasportano le cellule microgliali nelle vescicole potremmo ritrovare una serie infinita di endosomi, lisosomi, autosomi, e vescicole che contengono sostanze altamente tossiche, materiali infiammabili insieme a sostanze neurotrofiche etc etc. Di certo non è quello che si ritroverebbe in una borsa di un medico o infermiere.
Il Processo: L’accusa
 L’accusa inizia l’arringa con delle frasi taglienti e tendenziose. Secondo la sua ricostruzione le cellule microgliali, avvezze all’eutanasia, si sono dirette verso la zona sofferente dall’ipossia. I dati pubblici ci hanno depistato sull’effettivo orario di arrivo sul luogo del delitto, in realtà, recenti scoperte ci indicano che le cellule microgliali si trovavano già in loco prima del tempo dichiarato. Non è stato possibile vederle poiché sono arrivate con un travestimento non noto fino a poco tempo fa. Poi una volta arrivate sul luogo prefissato hanno iniziato a contornare alcuni neuroni in sofferenza. La microglia, adese ai neuroni ha liberato delle sostanze in uno spazio estremamente piccolo, troppo scarse per essere analizzate e troppo rapide per essere viste. In questo istante forse c’é stato un ‘errore’, ed al posto di sostanze neurotrofiche la microglia ha lasciato delle sostanze tossiche. Magari ha valutato che i neuroni non ce l’avrebbero fatta a passare indenni l’ipossia e li ha avvelenati in maniera irreversibile per eutanasia. Poi mentre i neuroni avvelenati stavano resistendo all’ipossia, il colpo di grazia, la microglia si é allontanata aggravando la situazione per il mancato sostentamento trofico. Ciò che ne é conseguito é la morte dei neuroni in circostanze apparentemente solitarie. Poi sono arrivate le cellule microgliali travestite da spazzine ed hanno pulito il luogo del delitto.
L’accusa inizia l’arringa con delle frasi taglienti e tendenziose. Secondo la sua ricostruzione le cellule microgliali, avvezze all’eutanasia, si sono dirette verso la zona sofferente dall’ipossia. I dati pubblici ci hanno depistato sull’effettivo orario di arrivo sul luogo del delitto, in realtà, recenti scoperte ci indicano che le cellule microgliali si trovavano già in loco prima del tempo dichiarato. Non è stato possibile vederle poiché sono arrivate con un travestimento non noto fino a poco tempo fa. Poi una volta arrivate sul luogo prefissato hanno iniziato a contornare alcuni neuroni in sofferenza. La microglia, adese ai neuroni ha liberato delle sostanze in uno spazio estremamente piccolo, troppo scarse per essere analizzate e troppo rapide per essere viste. In questo istante forse c’é stato un ‘errore’, ed al posto di sostanze neurotrofiche la microglia ha lasciato delle sostanze tossiche. Magari ha valutato che i neuroni non ce l’avrebbero fatta a passare indenni l’ipossia e li ha avvelenati in maniera irreversibile per eutanasia. Poi mentre i neuroni avvelenati stavano resistendo all’ipossia, il colpo di grazia, la microglia si é allontanata aggravando la situazione per il mancato sostentamento trofico. Ciò che ne é conseguito é la morte dei neuroni in circostanze apparentemente solitarie. Poi sono arrivate le cellule microgliali travestite da spazzine ed hanno pulito il luogo del delitto.
L’accusa continua rimarcando più volte il passato della microglia, come una cellula già avvezza al neuroomicidio (precedenti penali), inoltre ha mentito sull’orario di arrivo (depistaggi), si trovava vicino ai neuroni durante i fatti (opportunità), aveva dentro di sé l’arma del delitto (capacità), poteva girovagare indisturbato per il cervello con una discreta velocità (possibilità), si è allontanata con un travestimento prima che i neuroni si riprendessero causandone la morte (mancato soccorso). Ed in fine, l’arringa termina con una frase lapidaria: come nei più classici e proverbiali gialli, l’assassino è ritornato sul luogo del delitto ed ha rimosso le prove per fagocitosi (occultamento delle prove).
Non si tratta di un evento accidentale, ma di un pluriomicidio aggravato e premeditato di neuroni ed astrociti da parte di ‘servizi segreti deviati’ appartenenti al SNC.
La parola alla difesa
 La difesa risponde punto per punto con calma e freddezza.
La difesa risponde punto per punto con calma e freddezza.
Le multi identità sono parte del lavoro fisiologico della microglia. Queste cellule, infatti, in mancanza di collaboratrici, (es macrofagi, cellule presentanti l’antigene, cellule B etc,) devono necessariamente fare tutto da sole adattandosi di volta in volta alle nuove necessità. Sull’orario non c’é stata alcuna dichiarazione falsa, ogni cellula della microglia esprime o meno degli antigeni in funzione del lavoro che sta facendo, se non esistono ancora metodi per marcarli tutte ciò non indica alcuna colpevolezza.
Sulla questione delle sostanze tossiche e letali, é ovvio che una guardia giurata abbia sempre con sé la pistola ed il caricatore sempre pronti, tuttavia può anche avere con sé i materiali di primo soccorso. Fino ad ora non ci sono prove che la microglia abbia liberato sostanze tossiche verso i neuroni in quei momenti.
Anzi, l’imputato si è dimostrato utile per rimuovere le sostanze potenzialmente tossiche, ovvero quei residui post-ischemici che aumentano l’infiammazione e la sofferenza neuronale. Inoltre la microglia ha creato anche un ambiente idoneo per la formazione di nuove sinapsi per la ripresa post-danno.
La difesa poi ricorda che i topi transgenici che non hanno la microglia non sopravvivono all’embriogenesi, per cui stiamo trattando di cellule essenziali per la vita stessa. Poi cita gli innumerevoli casi in cui la microglia ha svolto ruoli eroici in difesa dei nostri delicati neuroni. Tutto questo non può essere cancellato da qualche sospetto e soprattutto da condizioni alle quali la microglia stessa non era preparata.
Se questo fosse un giallo…
 Se questo fosse un giallo non potrebbe mancare il classico colpo di scena. Questa volta arriva proprio da Mario Capecchi che scopre, in una sua recente pubblicazione su cell, che l’inattivazione della microglia provoca un fenotipo ossessivo-convulsivo. Quello che sorprende é che l’iniezione nel midollo osseo di cellule microgliali marcate e fluorescenti provoca la comparsa di cellule microgliali nel cervello. Ancora una volta la microglia ha mentito, e a quanto pare ha un passaggio segreto per oltrepassare la BEE, anche se oggi non é stato ancora possibile scoprire come. A quanto pare la microglia ha molti aspetti ancora oscuri, forse anche delle identità e dei passaporti che non conosciamo ancora.
Se questo fosse un giallo non potrebbe mancare il classico colpo di scena. Questa volta arriva proprio da Mario Capecchi che scopre, in una sua recente pubblicazione su cell, che l’inattivazione della microglia provoca un fenotipo ossessivo-convulsivo. Quello che sorprende é che l’iniezione nel midollo osseo di cellule microgliali marcate e fluorescenti provoca la comparsa di cellule microgliali nel cervello. Ancora una volta la microglia ha mentito, e a quanto pare ha un passaggio segreto per oltrepassare la BEE, anche se oggi non é stato ancora possibile scoprire come. A quanto pare la microglia ha molti aspetti ancora oscuri, forse anche delle identità e dei passaporti che non conosciamo ancora.
Inoltre come può l’iniezione midollare di una microglia inattiva causare un fenotipo psichiatrico? Siamo di fronte ad un personaggio davvero interessante.
Il giudizio
 Mettere insieme tutti questi dati sparsi non é semplice. Nella ricerca, infatti, é difficile soprattutto distinguere la verità obiettiva dalle interpretazioni, ed in questo lungo processo sono state fatte solo delle allusioni, niente di più. L’articolo di Capecchi parla di una interferenza sui recettori nocicettivi periferici da parte della microglia. Un topo con difficoltà nella percezione del dolore ha dei comportamenti anomali, ma non c’é niente di significativamente neurologico.
Mettere insieme tutti questi dati sparsi non é semplice. Nella ricerca, infatti, é difficile soprattutto distinguere la verità obiettiva dalle interpretazioni, ed in questo lungo processo sono state fatte solo delle allusioni, niente di più. L’articolo di Capecchi parla di una interferenza sui recettori nocicettivi periferici da parte della microglia. Un topo con difficoltà nella percezione del dolore ha dei comportamenti anomali, ma non c’é niente di significativamente neurologico.
La corte, quindi propone una nuova perizia. Verifichiamo cosa avviene in un topo transgenico capace di inattivare la funzione microgliale in maniera condizionata.
Il risultato é sconcertante, l’inattivazione condizionale della microglia, poco prima e durante l’ictus, provoca un notevole peggioramento del danno ischemico ed una sopravvivenza neuronale ridotta. Ovviamente ci sono state anche le critiche su quale gene é stato scelto per disattivare la microglia. Forse é stato scelto quel gene che sovraintende le funzioni microgliali ‘buone’. Si vedrà.
Tratta la somma, l’imputato é assolto per insufficienza di prove.
Conclusioni
Purtroppo, siamo ancora lontani dalla verità. Le indagini sulla microglia sono tutt’altro che concluse, si tratta di un campo in rapida espansione ed é sotto indagine per tantissime patologie come l’HIV, la sclerosi multipla, l’Alzheimer e tante altre patologie neurodegenerative.
Per ora il processo sull’ischemia é fermo per insufficienza di prove, ma qualcuno nel mondo sta ancora tentando di incastrare la microglia, chissà se ci sarà nuovamente qualche altro colpo di scena che la riporterà nuovamente sotto processo.
La ricerca, come al solito, non ha mai fine.
Alla prossima
Tags:
Animali transgenici,
Glia,
Ictus,
Ischemia Cerebrale,
microglia,
Neuroni
3 maggio 2010 - 2:08 pm
 Come funziona la memoria? Quali parti del cervello sono coinvolte e quali cellule? Un mistero ancora da svelare…Opinione comune nel mondo scientifico è che gli attori principali nel meccanismo mnemonico siano i neuroni. Tuttavia, nell’encefalo esistono altre cellule, in quantità molto maggiore. E se fossero gli astrociti, le cellule-stella, a darci le risposte di questi interrogativi?
Come funziona la memoria? Quali parti del cervello sono coinvolte e quali cellule? Un mistero ancora da svelare…Opinione comune nel mondo scientifico è che gli attori principali nel meccanismo mnemonico siano i neuroni. Tuttavia, nell’encefalo esistono altre cellule, in quantità molto maggiore. E se fossero gli astrociti, le cellule-stella, a darci le risposte di questi interrogativi?
Dopotutto, queste cellule costituiscono circa il 90% del tessuto cerebrale…
Continue Reading »
Tags:
Astrociti,
Attività sinaptica,
Calcio,
Cellule-stella,
D-serina,
Glutammato,
Ippocampo,
LTP,
Memoria,
Neuroni,
NMDA
28 aprile 2010 - 2:08 pm
Dieci piccoli indiani
Preambolo
Nella puntata precedente abbiamo visto un esempio di un delitto mirato ad uno dei punti cardini delle difese cellulari. I fatti ci dimostrano sempre più che la morte neuronale in seguito ad ischemia non sia un evento incidentale, ma voluto da qualcuno con le idee ben chiare su quali difese eliminare e chi distruggere secondo uno schema prestabilito.
Dieci piccoli indiani
 Per chi non ha tempo può leggere direttamente il prossimo paragrafo.
Per chi non ha tempo può leggere direttamente il prossimo paragrafo.
Nell’aprile del 1841, Edgar Allan Poe pubblicò “I delitti della Rue Morgue”, considerato da molti il primo racconto ‘poliziesco moderno’ della storia della letteratura. Pochi sanno che questo racconto rappresenta anche il primo esempio di un particolare tipo di giallo definito il “mistero della camera chiusa”. In questa tipologia di racconto si cerca di scoprire il responsabile di un delitto compiuto in circostanze apparentemente impossibili, poiché il bersaglio del crimine generalmente è isolato dal resto del mondo. Sicuramente si tratta di un genere letterario di difficile stesura, infatti molto spesso l’autore ricorre a passaggi segreti, all’intervento di animali o altro che sono sapientemente nascosti fino alla conclusione del racconto. Persino Conan Doyle, Edgard Allan Poe, e tanti altri prestigiosi autori hanno fatto ricorso a questi espedienti.
Probabilmente l’essenza del genere letterale è stata superbamente rappresentata da Agata Christie nel suo giallo intitolato “…e poi non rimase nessuno” poi aggiornato in “Dieci piccoli indiani”. Qui non vi è trucco né inganno, la storia narra di dieci persone che si ritrovano su di una isola deserta su cui all’arrivo verrà annunciata la morte di ciascun protagonista. La cosa sorprendente è che si verifica ciò che è esplicitamente scritto nel titolo, ovvero muoiono tutti e nessuno entra o esce dall’isola. Nella storia non vi è alcuna persona al di sopra di ogni sospetto e non vi è alcun Deus ex machina che risolve il delitto. L’intera storia è narrata dal di fuori dei personaggi senza entrare nella loro testa, mediante sguardi sospetti reciproci, dubbi, perplessità teorie varie. Sicuramente un capolavoro si psicologia e suspense che ha debitamente meritato il record di vendite di libri e le diverse trasposizioni cinematografiche.
Ovviamente non vi svelo il finale ma forse questa storia è interessante poiché potrebbe essere la chiave di lettura di questo post.
Il cervello in una stanza chiusa
 Le analogie tra i delitti della camera chiusa e l’ictus sono molteplici.
Le analogie tra i delitti della camera chiusa e l’ictus sono molteplici.
Il delitto ovviamente è consumato durante il propagarsi del danno neuronale e l’annuncio è dato dal mancato afflusso di sangue, ma perché si dovrebbe considerare il cervello come una stanza chiusa ed isolata?
Il cervello è avvolto da una barriera, detta ematoencefalica (BEE), che lo isola dal sangue circolante. In pratica solo pochissime sostanze controllatissime possono raggiungere l’encefalo mediante diffusione passiva oppure trasporto proteico.
Questa barriera ematoencefalica difende il nostro centro di comando e di pensiero dagli effetti potenzialmente dannosi di sostanze, virus o batteri che circolano nel nostro organismo. Persino i farmaci che dovrebbero agire sul SNC debbono avere delle caratteristiche molto particolari per raggiungere un singolo neurone. Oltrepassare la BEE non é per niente facile sia per entrare che per uscire dal cervello, sebbene esistano dei punti con maggiore permeabilità.
Ciononostante, oltre la BEE ci sono degli strati di astrociti che tamponano ulteriormente l’afflusso di sostanze dal sangue ai neuroni.
Il cervello, inoltre, é immerso in un liquido (liquor cerebrospinale) che serve per alleggerire il proprio peso, per attutire eventuali colpi alla testa e diminuire l’effetto degli sbalzi termici. Ebbene nuotando in questo liquido sarebbe possibile raggiungere quasi ogni regione cerebrale in poco tempo. Il liquido encefalorachidiano, infatti, oltre ad avvolgere completamente l’encefalo, il cervelletto fino al midollo allungato, passa anche dentro il cervello stesso attraversando dei vuoti detti ventricoli cerebrali. Questo é un meccanismo che permette una ottima estensione della superficie di contatto.
C’è da considerare, però, che il cervello è avvolto anche da involucri connettivali membranosi costituiti di 3 lamine concentriche particolarissime, definite, meningi. Dall’esterno verso l’interno all’interno c’è la dura madre (o dura meninge), l’aracnoide, e la pia madre (o pia meninge).
Il ruolo fondamentale delle meningi è la protezione meccanica del SNC ed impedire a sostanze tossiche, metaboliti e farmaci di penetrare dal sangue all’ambiente perineuronale. Serve anche per nutrire il tessuto cerebrale ed a riassorbire parte del liquor cerebrospinale.
Ritorniamo alle indagini
 Una volta constatato che c’é in giro un assassino molto furbo e raffinato, il primo punto in discussione oggi é la permeabilità, ovvero verificare se il cervello é veramente isolato oppure c’é qualche passaggio segreto che consentirebbe ad un malintenzionato di entrare e fuoriuscire indisturbato dalla scena del crimine.
Una volta constatato che c’é in giro un assassino molto furbo e raffinato, il primo punto in discussione oggi é la permeabilità, ovvero verificare se il cervello é veramente isolato oppure c’é qualche passaggio segreto che consentirebbe ad un malintenzionato di entrare e fuoriuscire indisturbato dalla scena del crimine.
Consideriamo ad esempio il ruolo del cervello nel sovraintendere le ghiandole endocrine dell’organismo. L’ipofisi è parte del SNC e stimola numerose funzioni del nostro organismo attraverso la liberazione di numerosi ormoni proteici e non. Come può svolgere questa funzione al di là della barriera? Indagando bene la BEE ha delle piccolissime zone di ‘fenestramento’. Zone in cui la barriera é più sottile e passano più facilmente gli ormoni proteici. Tuttavia queste zone non possono essere facilmente utilizzate per far entrare farmaci, poiché rappresentano una superficie estremamente piccola e con un percorso per raggiungere tutto il sistema nervoso centrale molto lungo. Qualsiasi sostanza o cellula che voglia intraprendere questo percorso dovrebbe oltrepassare la BEE, poi una serie di barriere gliali, assonali, l’ipofisi e poi tutto il cervello per arrivare alla corteccia dove avverrà l’ictus. Un percorso troppo lungo e complicato per una qualsiasi sostanza da poter sostenere come realistica.
Ci può essere però un’eccezione nota a tutti. Si sa, infatti, che i linfociti ed i macrofagi si ritrovano nel sangue e possono attraversare l’endotelio dei capillari senza causare danni e soprattutto in maniera mirata per raggiungere il sito di infiammazione.
Potremmo considerare l’ischemia cerebrale con una componente infiammatoria e quindi potremmo anche pensare che ci sia una possibilità per le cellule infiammatorie attivate di oltrepassare le barriere e ritrovarsi nel SNC.
Andiamo in laboratorio e riproduciamo l’ictus in un modello animale ed osserviamo il cervello e le cellule accorse sul luogo del danno. La prima sorpresa é che nel SNC non ci sono le classiche cellule del sistema immunitario né in condizioni fisiologiche e neanche in corso di infezione. Il cervello, infatti, é privo di linfociti, macrofagi ed altre cellule classiche del sistema immunitario. Per difendersi il cervello presenta una particolare forma di glia che fa le veci del sistema immunitario. Si definisce microglia, una particolare forma di glia che di fatto é una forma di cellule immunitarie residente nel SNC. Rappresentano circa il 20% della popolazione gliale, e circolano liberamente attraverso la stretta maglia dei neuroni e della glia in cerca di neuroni danneggiati, placche e agenti infettivi. Ovviamente si dirigono sul luogo dell’infiammazione o sul sito di richiamo ed hanno funzioni molto interessanti.
La microglia
 Immaginiamo un ipotetico interrogatorio per conoscere meglio il nostro candidato.
Immaginiamo un ipotetico interrogatorio per conoscere meglio il nostro candidato.
“Lei chi è e cosa ci fa in questa ‘casa’?”
“Io sono parte integrante del sistema immunitario. Il mio ruolo è quello di proteggere gli abitanti del cervello da eventuali infezioni od eventi dannosi.”
“Perché non ci sono le cellule del sistema immunitario qui?”
“Perché non è possibile passare attraverso la BEE, i macrofagi, le cellule B ed altre sono recluse fuori ed io sono reclusa dentro il cervello. Non sono possibili scambi”
“Se ho capito bene Lei non è né una forma neuronale e nemmeno una vera glia. Da dove viene Lei?”
“Io derivo dalle cellule staminali ematopoietiche, le stesse che danno origine alle altre cellule del sistema immunitario”
“Allora Lei come ha fatto ad entrare qui senza attraversare la BEE? C’è qualche passaggio segreto forse?”
“Le cellule microgliali sono originate durante l’embriogenesi, quando la BEE non esisteva ancora. In pratica una piccola popolazione di cellule staminali ematopoietiche migrano in quello che sarà il SNC e si differenziano in microglia. Una volta chiusa la BEE nessuno entra e nessuno esce”
“uhmm… c’è una cosa che non mi quadra. I macrofagi, le cellule dendritiche, e tantissime altre cellule del sistema immunitario spesso si usurano e vengono rimpiazzati da altre cellule nuove che si differenziano secondo le necessità. Lei non invecchia mai? Non riceve mai un rinforzo dall’esterno per combattere le infezioni?”
“In verità no. Le cellule del midollo osseo non possono aiutarmi in alcun modo, poiché non possono attraversare la BEE, quindi siamo sole e facciamo il possibile.”
“…e quando si trova in difficoltà? Come fa?”
“La BEE generalmente non lascia passare molti organismi patogeni e ciò basta per un equilibrio. Tuttavia, se le circostanze lo richiedono abbiamo una discreta capacità di replicazione e possiamo combattere gli agenti patogeni con notevole forza.”
“Alcuni esperti sostengono che i suoi progenitori sono in grado di accorrere nel SNC quando ci sono infezioni molto gravi. Devo dedurre che c’è qualche modo per oltrepassare la BEE”
“Questo capita quando l’infiammazione o chi l’ha causata danneggia la BEE, in questo caso è possibile che dei nostri progenitori abbiamo abbastanza spazio per attraversare la BEE e differenziarsi in loco per combattere al nostro fianco.”
Il sospetto
 Qualcosa non quadra perfettamente. Il sistema immunitario è un complesso meccanismo di riconoscimento degli agenti infettivi attraverso diversi tipi di cellule specializzate. Un agente infettivo può essere riconosciuto in maniera innata oppure attraverso l’apprendimento, in ogni caso gli anticorpi hanno un ruolo essenziale per tale riconoscimento. Nessuna cellula può essere in grado di riconoscere tutte le possibili combinazioni di agenti infettivi non-self.
Qualcosa non quadra perfettamente. Il sistema immunitario è un complesso meccanismo di riconoscimento degli agenti infettivi attraverso diversi tipi di cellule specializzate. Un agente infettivo può essere riconosciuto in maniera innata oppure attraverso l’apprendimento, in ogni caso gli anticorpi hanno un ruolo essenziale per tale riconoscimento. Nessuna cellula può essere in grado di riconoscere tutte le possibili combinazioni di agenti infettivi non-self.
Proviamo a stringere l’interrogatorio sul nostro indagato
“Come fa a riconoscere un agente infettivo? La BEE non lascia passare nemmeno gli anticorpi, e senza le cellule B è improponibile saper riconoscere tutti i possibili agenti patogeni.”
“Da questa parte della BEE ci dobbiamo arrangiare a riconoscere gli agenti patogeni attraverso piccoli cambiamenti patologici che hanno luogo nel SNC. In verità ci sono solo poche e controllatissime cellule nel SNC, ogni cosa fuori posto è subito notata. Ad esempio ci possono essere anche dei piccoli cambiamenti nell’ambiente ionico del cervello per indicare una certa sofferenza”
“Si è mai sbagliato a riconoscere un estraneo? In altre parole ha mai riconosciuto come patogeno o infettivo un neurone?”
“A volte mi è capitato, specie quando un neurone sta per morire si attiva un meccanismo di fagocitosi e rimozione dei residui prima che i frammenti possano danneggiare le cellule circostanti. Oppure in alcune patologie dove i neuroni invecchiano precocemente e sono costretto ad intervenire”
“…e nel caso di ictus? Ha trovato in questo caso degli agenti infettivi? O ha praticato eutanasia su qualche cellula del SNC?”
“In verità sono accorso quanto prima cercando di capire perché morivano così tanti neuroni, ma non ho potuto far nulla per salvarli”
“Perché Lei non è morto durante il propagarsi del danno neuronale insieme ai neuroni ed alla glia?”
“Sono stato chiamato in ritardo dai neuroni danneggiati, sono accorso quanto prima ma la situazione era già disperata, ho provato a liberare sostanze per sostenere i neuroni, ma quando le cose sono andate male mi sono allontanato per salvarmi”
Conclusione
In questo post abbiamo introdotto un nuovo individuo del SNC, un terzo incomodo misterioso che coabita con le vittime e che ha un comportamento alquanto strano. Nel prossimo post lo sottoporremo ad un vero processo per capire bene il suo ruolo e la sua posizione in questo intricato giallo.
Alla prossima
Tags:
barriera ematoencefalica,
Glia,
Ictus,
Ischemia Cerebrale,
microglia,
Neuroni
25 gennaio 2010 - 3:58 pm
Preambolo
Oggi continuiamo il viaggio tra le righe di questo misterioso neuroomicidio in seguito ad ischemia cerebrale. Per chi non avesse seguito i capitoli precedenti siamo sule tracce di un apparente cameriere innocuo che nasconde dietro di sé una inquietante storia. Questo personaggio, rappresentato dalla proteina di membrana NCX, sembra essere coinvolto nel danno ischemico del cuore. Oggi vedremo di traslare la ricerca al cervello e di capire come stanno effettivamente le cose.
I gemelli
 Per chi si annoia facilmente può passare subito al prossimo paragrafo, se siete curiosi, invece, in questa sezione descriveremo un breve racconto che ci potrebbe essere utile per la nostra storia.
Per chi si annoia facilmente può passare subito al prossimo paragrafo, se siete curiosi, invece, in questa sezione descriveremo un breve racconto che ci potrebbe essere utile per la nostra storia.
Sicuramente conoscerete almeno un po’ della letteratura greca e della sua mitologia che descrive l’origine di tutte le cose naturali, incluse le costellazioni. In questa ‘letteratura’ la costellazione dei gemelli presenta, per una strana combinazione, due storie diverse e contrastanti. La prima storia é quella più diffusa, che racconta dei due fratelli gemelli di Elena di Troia in cerca del vello d’oro con gli argonauti. L’altra storia meno nota, invece, racconta di un re greco che ebbe due gemelli come primo genito. Questo avvenimento era considerato un segno di sventura, poiché la tradizione dell’epoca dava al solo primo figlio maschio l’eredità reale, ed avere due gemelli comportava dividere il regno. Coscienti di ciò, l’ostetrica insieme a pochi fidati nascosero il secondo parto ed abbandonarono il fagotto lontano dal palazzo reale. Il primo figlio divenne un re buono e giusto, mentre il secondo visse nell’ombra e dovette arrancare per vivere. Quando scoprì la propria somiglianza con il regnante, pensò bene di prendersi di diritto il trono e spodestare il gemello. Nessuno si accorse dell’inganno tant’é che i sudditi avvertirono questo scambio tra gemelli come un improvviso cambio di pensiero del re, da buono e giusto ad un aguzzino sanguinario. Per chi non conoscesse il seguito della storia sono sicuro che riuscirà a trovarla con un paio di click. É curioso che ancora oggi, a causa di questa seconda origine mitologica, i gemelli sono spesso disegnati con due volti diversi, uno sereno e sorridente, l’altro cattivo.
Come in tutti i racconti greci, c’é dietro un pensiero filosofico. Probabilmente il racconto ci insegna a suo modo che i cambiamenti del comportamento possono essere determinati dalla confusione tra più persone, oppure secondo un altro punto di vista più teologico, che dentro ognuno di noi ci possono essere più personalità con lo stesso volto esteriore.
Conosci con chi vai e saprai chi sei.
 Il primo punto in discussione oggi é l’uso di farmaci specifici per limitare la funzione di NCX durante il danno ischemico. Questo ci darebbe un inestimabile contributo alla comprensione del suo ruolo in senso positivo o negativo. Purtroppo, come abbiamo già accennato più volte i farmaci agiscono anche su altri bersagli, es canali ionici e recettori, quindi sono inutili. Tuttavia c’é un dubbio, perché tutti gli esperimenti fatti con queste sostanze presentano un unico risultato coincidente quando si tratta di ischemia cardiaca, mentre nell’ischemia cerebrale ci sono risultati molto discordanti?
Il primo punto in discussione oggi é l’uso di farmaci specifici per limitare la funzione di NCX durante il danno ischemico. Questo ci darebbe un inestimabile contributo alla comprensione del suo ruolo in senso positivo o negativo. Purtroppo, come abbiamo già accennato più volte i farmaci agiscono anche su altri bersagli, es canali ionici e recettori, quindi sono inutili. Tuttavia c’é un dubbio, perché tutti gli esperimenti fatti con queste sostanze presentano un unico risultato coincidente quando si tratta di ischemia cardiaca, mentre nell’ischemia cerebrale ci sono risultati molto discordanti?
La storia, scientifica e letteraria, ci insegna che dietro ai comportamenti ambigui ci sono sempre delle verità più profonde da scoprire. Per questo, prima di andare dal nostro indagato e sbattergli in faccia quello che abbiamo scoperto sul suo ruolo nel cuore, cercheremo ci informarci meglio sul suo conto.
La disparità dei farmaci su NCX nel cervello puzza di bruciato, appesantito poi dall’effetto convergente sul cuore. Andiamo quindi in laboratorio in cerca di maggiori informazioni. Tenendo presente la storia mitologica accennata prima cerchiamo subito di chiarire eventuali confusioni di persona. Conoscendo la sequenza del nostro gene target possiamo seguire due strade principali per la scoperta di eventuali gemelli, una via più predittiva e teorica oppure una via più sperimentale ed alchimica.
La veggenza
 La tecnica più semplice oggi é quella che fa uso della bioinformatica per la ricerca di geni o pseudogeni simili al nostro indagato. Si tratta di un approccio molto economico ma che richiede un certo grado di esperienza e pazienza. Sappiamo infatti che il genoma umano, come quello di altri organismi, é stato interamente sequenziato, per cui i geni sono sotto gli occhi di qualsiasi curioso. Un po’ come avere un dizionario in cui compaiono tutte le parole italiane, possiamo raggrupparle in aggettivi, verbi, soggetti etc, oppure per sinonimi e contrari. Lo stesso vale per le sequenze ritrovate nel genoma umano, dove partendo da un preciso gene, si può facilmente risalire ad un suo analogo, per omologia di sequenza nucleotidica o addirittura aminoacidica.
La tecnica più semplice oggi é quella che fa uso della bioinformatica per la ricerca di geni o pseudogeni simili al nostro indagato. Si tratta di un approccio molto economico ma che richiede un certo grado di esperienza e pazienza. Sappiamo infatti che il genoma umano, come quello di altri organismi, é stato interamente sequenziato, per cui i geni sono sotto gli occhi di qualsiasi curioso. Un po’ come avere un dizionario in cui compaiono tutte le parole italiane, possiamo raggrupparle in aggettivi, verbi, soggetti etc, oppure per sinonimi e contrari. Lo stesso vale per le sequenze ritrovate nel genoma umano, dove partendo da un preciso gene, si può facilmente risalire ad un suo analogo, per omologia di sequenza nucleotidica o addirittura aminoacidica.
Per farlo basta un pc, una connessione internet, i servizi da Italia-IPTV.it, qualche programma specializzato e tanta buona volontà. Il tutto dovrebbe essere condito anche con una buona dose di pazienza, poiché questa metodologia non é perfetta e capita spesso di essere abbagliati da errori, pseudogeni o sequenze che in realtà si esprimono solo in particolari cellule o particolari condizioni che non ci interessano.
Ciononostante ci armiamo di impegno e pazienza alla ricerca di geni simili al nostro imputato. Da un’analisi preliminare emerge subito che ci sono diverse sequenze simili al nostro NCX, alcune possono essere escluse poiché non portano all’espressione una proteina completa, altre non presentano i classici segni dell’espressione (expressed sequence tags = EST). Dai nostri sforzi sembrano emergere tutto e nulla contemporaneamente.
Tuttavia, valutando bene, ci sono due zone della nostra sequenza genica che sono molto conservate e si ritrovano in tante altre sequenze. Raccolte queste informazioni possiamo procedere all’identificazione degli altri possibili mRNA, e vedere per quale proteina codificano e se qualcuna di queste possa somigliare al nostro cameriere.
L’alchimia
 Un seconda fase o secondo approccio potrebbe essere quello di cercare gli mRNA target direttamente su cellule o tessuto. Questo é necessario per verificare se quei candidati identificati con il pc sono poi effettivamente espressi nell’organo che ci interessa, es cervello, oppure trovare degli mRNA che ci sono sfuggiti perché magari hanno delle strutture genetiche insolite.
Un seconda fase o secondo approccio potrebbe essere quello di cercare gli mRNA target direttamente su cellule o tessuto. Questo é necessario per verificare se quei candidati identificati con il pc sono poi effettivamente espressi nell’organo che ci interessa, es cervello, oppure trovare degli mRNA che ci sono sfuggiti perché magari hanno delle strutture genetiche insolite.
La seconda strada che possiamo percorrere, quindi, é alternativa alla prima ed anche complementare a questa.
In teoria, dobbiamo prendere l’RNA del tessuto o organo che ci interessa e cercare delle sequenze omologhe con la tecnica Race. Con questa tecnica, infatti, é possibile individuare i membri di una famiglia di mRNA, partendo dalla conoscenza di alcune regioni conservate.
Risultati
 Dall’analisi risulta subito evidente che NCX é una proteina unica in quasi tutto l’organismo, tranne nel cervello e nel muscolo scheletrico. Definiamo NCX1, l’isoforma ubiquitaria, mentre NCX2 e NCX3 sono quelle che si trovano solo nel cervello e nel muscolo scheletrico.
Dall’analisi risulta subito evidente che NCX é una proteina unica in quasi tutto l’organismo, tranne nel cervello e nel muscolo scheletrico. Definiamo NCX1, l’isoforma ubiquitaria, mentre NCX2 e NCX3 sono quelle che si trovano solo nel cervello e nel muscolo scheletrico.
NCX1, NCX2 e NCX3 sono generati da 3 geni diversi ed hanno la medesima struttura (topologia) e funzione. Sono talmente simili in sequenza aminoacidica che é possibile generare delle proteine chimeriche con pezzi di ciascuna isoforma senza alterarne la funzione e regolazione. Probabilmente la presenza di più geni con funzioni simili potrebbe essere dovuto alla ridondanza, tipica di geni molto importanti. Proprio questo é in contrasto con un possibile ruolo negativo.
Da qui la prima possibile spiegazione sui farmaci, probabilmente hanno selettività diverse per le isoforme di NCX e di conseguenza hanno anche risultati diversi. Se prima eravamo in dubbio sul ruolo di una singola proteina, adesso ne abbiamo tre. In pratica ci siamo avvicinati al vero e ci siamo accorti di essere notevolmente distanti dal concludere le indagini.
Qual é il ruolo di queste proteine?
 Quando le cose si complicano é meglio semplificare.
Quando le cose si complicano é meglio semplificare.
Per capire bene la funzione di ogni singola proteina andiamo in laboratorio e transfettiamo stabilmente queste proteine in altrettante linee cellulari. In questo modo possiamo evidenziare il comportamento individuale di ogni isoforma e nel contempo siamo in un sistema più facile da controllare ed analizzare.
La prima notizia é che le cellule costrette ad esprimere questo scambiatore sembrano non soffrirne affatto in condizioni fisiologiche. Se però volessimo considerare delle condizioni patologiche, ad esempio un overload di calcio?
Per sovraccaricare di calcio le cellule possiamo aggiungere al mezzo la ionomicina, una sostanza tossica che forma dei pori sulla membrana plasmatica e fa entrare quantità massicce di calcio. Le cellule wild-type muoiono poco dopo l’incubazione, mentre le cellule che esprimono NCX sopravvivono senza difficoltà.
Tutte le isoforme, NCX1, NCX2, e NCX3 hanno lo stesso effetto protettivo in egual misura, ma qualcosa non quadra; stessa funzione=stesso ruolo?
Se proviamo a testare i farmaci incriminati ci accorgiamo subito che c’é una discreta selettività. Alcuni farmaci agiscono su una isoforma in particolare, altri farmaci agiscono solo in determinare condizioni ioniche. L’ipotesi premessa sembra essere vera e quindi la strada farmacologica non é percorribile.
Sorpresa!
 Nella ricerca, come nelle indagini poliziesche, può capitare spesso di essere abbagliati e di semplificare troppo le cose, ora ne vedremo un esempio.
Nella ricerca, come nelle indagini poliziesche, può capitare spesso di essere abbagliati e di semplificare troppo le cose, ora ne vedremo un esempio.
Questa volta cerchiamo di sottoporre le cellule a stimolazioni più simil-ischemiche, non più solo sostanze tossiche. Una possibilità é di sottoporre le cellule che esprimono ciascuna isoforma ad una deprivazione di ossigeno e glucosio (OGD). In questo modo il modello é più complesso e simile all’ischemia, vedremo quale proteina ha un effetto protettivo e quale ha un effetto letale.
I risultati sentenziano che NCX3 é l’unica proteina con capacità protettiva in quelle condizioni. NCX2 e NCX1 sembrano non avere alcun effetto.
La situazione sembra essere interessante, ma perché le due proteine NCX1 e NCX2 non fanno nulla durante l’OGD mentre sono fondamentali nell’overload di calcio con la ionomicina? Dopotutto hanno la stessa struttura e funzione di NCX3. Qui é la sorpresa, presi per la gola ed interrogati per bene, NCX1 e NCX2 confessano entrambi che seppur non consumino ATP per funzionare, in realtà l’ATP stesso é un regolatore della funzione degli scambiatori. In pratica in assenza di questa molecola i due indagati non agiscono, anche se in teoria potrebbero. Ovviamente durante l’ischemia cerebrale c’é una carenza di ATP e questo avrebbe bloccato ogni azione di scambio ionico proprio come avverrebbe per le pompe ioniche. NCX3 invece é diverso e non é regolato dalla presenza di ATP, quindi era l’unico che poteva agire inisturbato, ma per fare cosa?
Una nuova strategia
 Tenuto conto che il nostro sospettato é NCX3, e che in vitro sembra essere neuroprotettivo, andiamo a vedere cosa succede in vivo durante l’ischemia cerebrale vera.
Tenuto conto che il nostro sospettato é NCX3, e che in vitro sembra essere neuroprotettivo, andiamo a vedere cosa succede in vivo durante l’ischemia cerebrale vera.
Per farlo possiamo utilizzare una nuova strategia interessante, ovvero abbassare l’espressione del nostro indagato con gli oligonucleotidi antisenso o con l’RNA interference direttamente nell’animale vivo. Il risultato é sconcertante, basta anche un lieve abbassamento dell’espressione di NCX3 per causare un notevole peggioramento del danno ischemico.
A qesto punto possiamo effettuare la prova del nove; ovvero generiamo un topo ko per NCX3 e verificare se ciò è confermato. Il topo ko sembra essere vitale e non avere alcun problema, sottoposto ad ischemia cerebrale i dati ci danno ragione. I topi ko per NCX3 presentano un volume ischemico notevolmente maggiore rispetto ai loro fratelli wild-type, soprattutto nelle prime fasi del danno. Tra tanti assassini abbiamo trovato un prode paladino della nostra sicurezza.
Se questa fosse una storia di fantasia…
Se questa fosse solo una storia di fantasia terminerebbe qui, con un buon presagio ed un possibile target farmaceutico per limitare l’estensione del danno cerebrale. Purtroppo spesso la realtà é molto più sorprendente di tutti gli scrittori di gialli. La storia non finisce qui, infatti, poiché su due autorevolissimi giornali scientifici, cell e nature, compaiono due articoli su un argomento che già era nell’aria da un po’ e che cambierà drasticamente la visuale della nostra storia.
La notizia
 Tutti i ricercatori che hanno trattato direttamete o indirettamete la proteina NCX3 sapevano già da tempo che nei western blot degli estratti cerebrali compaiono diverse bande oltre a quella corrisponde ad NCX3. In realtà non si ha ancora un anticorpo monoclonale per questa isoforma e neppure un policlonale perfetto per cui spesso si è tralasciato una scottante verità. Durante l’ischemia cerebrale l’espressione di NCX3 tende a diminuire nel centro dell’ischemia, mentre aumenta nelle zone peri-infartuate. Qualcosa richiama l’attenzione sul fatto che i neuroni attorno all’area ischemica tentano di esprimere le proteine di emergenza perché si trovano sul fronte ischemico e vogliono resistere. Tuttavia all’improvviso, queste stesse cellule perdono l’espressione di NCX3 e muoiono di lì a poco. Il western delle aree ischemiche, infatti, é povero della banda di NCX3, mentre compaiono invece altre bande a basso peso molecolare.
Tutti i ricercatori che hanno trattato direttamete o indirettamete la proteina NCX3 sapevano già da tempo che nei western blot degli estratti cerebrali compaiono diverse bande oltre a quella corrisponde ad NCX3. In realtà non si ha ancora un anticorpo monoclonale per questa isoforma e neppure un policlonale perfetto per cui spesso si è tralasciato una scottante verità. Durante l’ischemia cerebrale l’espressione di NCX3 tende a diminuire nel centro dell’ischemia, mentre aumenta nelle zone peri-infartuate. Qualcosa richiama l’attenzione sul fatto che i neuroni attorno all’area ischemica tentano di esprimere le proteine di emergenza perché si trovano sul fronte ischemico e vogliono resistere. Tuttavia all’improvviso, queste stesse cellule perdono l’espressione di NCX3 e muoiono di lì a poco. Il western delle aree ischemiche, infatti, é povero della banda di NCX3, mentre compaiono invece altre bande a basso peso molecolare.
L’articolo pubblicato su cell dimostrerà, infatti, che durante l’ischemia cerebrale ‘qualcuno’ dall’interno uccide NCX3 poiché é proprio l’ultima difesa del neurone per la sopravvivenza. Si tratta di una serie di tagli netti in più punti che provocano la scomparsa di NCX3 intero dalle cellule e la comparsa di una serie di bande proteolitiche.
Uno shock dunque ripreso anche da Nature sul dubbio della selezione naturale e perché abbiamo un vero e proprio assassino nel nostro cervello che, agendo nella confusione, taglia e degrada in maniera specifica e selettiva proprio le nostre difese migliori lasciando intatte NCX1 e NCX2 ferme a guardare poiché sono impossibilitate ad agire in assenza di ATP.
Conclusioni
In questa lunga puntata shock abbiamo scoperto ancora una volta la complessità del caso e soprattutto una volontà programmata di uccidere i neuroni. C’é sicuramente un mandante dell’omicidio e che sa bene il fatto suo, poiché degrada in maniera chirurgica solo le proteine che servono per le nostre difese, lasciando intatte quelle che non possono comunque fare nulla.
Alla prossima
Tags:
ATP,
Bioinformatica,
Ischemia Cerebrale,
NCX,
ncx3,
Neuroni
15 settembre 2009 - 6:48 pm
Qualcuno disse che non ci può essere giallo dove non ci sia anche il maggiordomo e la servitù. Il nostro poliziesco non ne è immune ovviamente, vediamo il proseguio delle indagini.
Preambolo
Continuiamo il nostro percorso in questo strano giallo, per chi non avesse seguito le puntate precedenti vi prego di visitare i seguenti links 1, 2, 3 e 4. Qui tratteremo un post di ‘transizione’, molto più semplice dei precedenti, ma che ci serve per capire i prossimi capitoli che saranno un po’ più complessi del solito.
Data la lunghezza eccessiva ho deciso di tagliare la storia in più sezioni, in questa vi presento la premessa (l’incontro). Come al solito sono bene accetti commenti di ogni tipo, suggerimenti per gli argomenti da trattare o migliorare.
La quiete dopo la tempesta
 Come abbiamo visto nel precedente post, il nostro ispettore cellulare è stato improvvisamente freddato dallo scagionamento del primo imputato eccellente. La teoria iniziale non faceva una grinza e c’erano anche molti indizi pesanti contro l’accusato. Purtroppo con il tempo e con l’uso di sostanze sempre più specifiche per il blocco del fattore transcrizionale la teoria della difesa ha avuto sempre più supporto. HIF-1 non è sicuramente una proteina da mettere tra i cattivi per l’ischemia cerebrale. A quanto pare c’è stato un grosso fallimento da cui abbiamo imparato a non concludere facilmente le indagini prima di approfondirle con cura.
Come abbiamo visto nel precedente post, il nostro ispettore cellulare è stato improvvisamente freddato dallo scagionamento del primo imputato eccellente. La teoria iniziale non faceva una grinza e c’erano anche molti indizi pesanti contro l’accusato. Purtroppo con il tempo e con l’uso di sostanze sempre più specifiche per il blocco del fattore transcrizionale la teoria della difesa ha avuto sempre più supporto. HIF-1 non è sicuramente una proteina da mettere tra i cattivi per l’ischemia cerebrale. A quanto pare c’è stato un grosso fallimento da cui abbiamo imparato a non concludere facilmente le indagini prima di approfondirle con cura.
Siamo quindi costretti a ritornare sui nostri passi ed ricominciare le indagini dall’inizio con più zelo, cercando di raccogliere informazioni sempre più precise e concordanti su cosa stava accadendo ai neuroni poco prima di morire.
Direi di iniziare l’interrogatorio su tutti i possibili testimoni oculari o detentori di informazioni cruciali.
Dove trovare i colpevoli?
 Pensare all’ipossia come innesco di un meccanismo che porterà a morte inevitabile per i neuroni non è male come teoria, tuttavia ci sono dei ricercatori che la pensano diversamente. Una volta, in un congresso un mio amico mi fece un’obbiezione inappellabile… per quanto possa essere interessante quel meccanismo che innesca la morte delle cellule, non c’è modo di evitarlo, un paziente arriva al pronto soccorso quando manifesta già i sintomi, ovvero quando c’è già stato “l’innesco letale”. Inoltre non è neanche possibile prevedere quando un individuo avrà un ictus, la nostra unica possibilità di aiutarlo risiede proprio in quella finestra di tempo che intercorre tra la comparsa dei sintomi e l’effettiva morte neuronale.
Pensare all’ipossia come innesco di un meccanismo che porterà a morte inevitabile per i neuroni non è male come teoria, tuttavia ci sono dei ricercatori che la pensano diversamente. Una volta, in un congresso un mio amico mi fece un’obbiezione inappellabile… per quanto possa essere interessante quel meccanismo che innesca la morte delle cellule, non c’è modo di evitarlo, un paziente arriva al pronto soccorso quando manifesta già i sintomi, ovvero quando c’è già stato “l’innesco letale”. Inoltre non è neanche possibile prevedere quando un individuo avrà un ictus, la nostra unica possibilità di aiutarlo risiede proprio in quella finestra di tempo che intercorre tra la comparsa dei sintomi e l’effettiva morte neuronale.
Se ci pensate è assurdo che le cellule siano ancora vive quando arrivano nelle nostre mani, e nonostante i nostri mezzi siamo incapaci evitarne la morte. Se vogliamo veramente fare qualcosa il primo punto dell’ordine del giorno deve essere fermare l’arma che ucciderà i neuroni, e solo dopo capire chi ha innescato il meccanismo ed è colpevole (scoprire il mandante).
Nel nostro caso dovremmo soffermarci sul perché le cellule non riescono più a gestire il calcio e muoiono. La soluzione di questo enigma sarà certamente correlata con la possibilità di salvare le cellule, mentre la cattura del mandante che ha scatenato la serie di eventi non servirà ad evitare nessun decesso cellulare al momento. Solo in un passaggio successivo potremmo chiarire anche chi ha causato tale massacro neuronale e perché.
Seguendo questa linea di pensiero in questo post ci concentreremo sui meccanismi di controllo e mantenimento dell’omeostasi ionica, cercando di fare il punto della situazione per poi trarne degli indizi.
La prima domanda è chi mantiene in ordine le concentrazioni ioniche intra ed extra cellulari?
 Se fate questa domanda ad un qualsiasi esperto nel settore vi dirà che ci sono migliaia di proteine che fanno ‘ordine’ tra i diversi ioni, e sono divise in famiglie, superfamiglie e classi. Questi meccanismi possono dividersi grossolanamente in pompe e trasportatori, in base al fatto che usano direttamente, o no, l’ATP.
Se fate questa domanda ad un qualsiasi esperto nel settore vi dirà che ci sono migliaia di proteine che fanno ‘ordine’ tra i diversi ioni, e sono divise in famiglie, superfamiglie e classi. Questi meccanismi possono dividersi grossolanamente in pompe e trasportatori, in base al fatto che usano direttamente, o no, l’ATP.
Tra le pompe più famose ci sono la Na+/K+ ATPasi che estrude sodio e fa entrare potassio, la pompa del calcio di membrana ed endoplasmatica (PMCA e SERCA), etc. Tra i trasportatori passivi i più noti sono lo scambiatore sodio/calcio (NCX), lo scambiatore sodio/calcio potassio (NCKX), lo scambiatore sodio/idrogeno (NHE), ed altri. Si tratta di un gruppo enorme di proteine che mettono continuamente in ordine i vari ioni, riportando continuamente le condizioni cellulari allo stato di riposo dopo le stimolazioni nervose che sono servite per attivare la cellula e per comunicare con il neurone successivo. E’ un po’ come avere delle cameriere e dei maggiordomi in una grande villa che mettono continuamente in ordine le camere ogni qual volta sono utilizzate.
Oggi ci concentreremo proprio su questi personaggi che stavano lì quando dalla calma apparente si è scatenata la disfatta neuronale.
La domanda ora è ‘Perché non hanno funzionato a dovere nel momento del bisogno?’
Vale la pena rispondere con chiarezza.
Prima domanda: Chi era in servizio durante l’ischemia e poco prima?
 A questa domanda c’è una risposta più o meno ovvia. Poco prima dell’ischemia funzionava tutto come al solito, nulla lasciava presagire il disastro, e tutte le proteine risiedevano al loro nomale posto fino a che è mancata l’energia necessaria per il trasporto attivo degli ioni. Quando è iniziata a mancare l’energia l’efficienza del trasporto ionico si è ridotta mentre il disordine ionico dei neuroni aumentava. Poco dopo questa fase gli unici che potevano fare qualcosa erano gli scambiatori ionici che non necessitano di ATP, ma il destino della cellula era oramai segnato; senza ATP non si può andare avanti per molto. Poi d’improvviso è arrivata nuova energia e tutto è cominciato a rifunzionare alla normalità fino al danno irreparabile.
A questa domanda c’è una risposta più o meno ovvia. Poco prima dell’ischemia funzionava tutto come al solito, nulla lasciava presagire il disastro, e tutte le proteine risiedevano al loro nomale posto fino a che è mancata l’energia necessaria per il trasporto attivo degli ioni. Quando è iniziata a mancare l’energia l’efficienza del trasporto ionico si è ridotta mentre il disordine ionico dei neuroni aumentava. Poco dopo questa fase gli unici che potevano fare qualcosa erano gli scambiatori ionici che non necessitano di ATP, ma il destino della cellula era oramai segnato; senza ATP non si può andare avanti per molto. Poi d’improvviso è arrivata nuova energia e tutto è cominciato a rifunzionare alla normalità fino al danno irreparabile.
In questa indagine tutto è sottoposto alla lente di ingrandimento, e nulla è dato per scontato, quindi le dichiarazioni vanno convalidate e come al solito andiamo in laboratorio con una ricostruzione del delitto per cercare di confutare tali ipotesi. In questo caso potremmo ricorrere ad esperimenti in vitro fatto con delle cellule neuronali sottoposte a dei modelli di deprivazione di ossigeno e glucosio, seguito dalla riossigenazione. Si tratta ovviamente di un modello molto semplice, ma che ci evita di sacrificare animali, e consente un maggiore grado di controllo delle condizioni sperimentali. Effettivamente quando manca ATP funzionano solo i trasportatori passivi, e la loro capacità di controllare l’omeostasi ionica è discreta considerando le condizioni di emergenza. Inoltre nulla sembra cambiare nell’assetto dei vari trasportatori attivi e passivi, dopotutto non c’è abbastanza energia e tempo per cambiare le cose con una sintesi/degradazione proteica. I sistemi sono ri-settati all’essenziale ed a tutto quello che può aiutare a tamponare i danni o trarre energia.
Se tutte queste considerazioni sono vere dobbiamo escludere chi non poteva funzionare al momento dell’ictus e considerare invece solo chi poteva ed ha fatto qualcosa…
La prossima domanda è quindi: Chi funzionava al momento e cosa stava facendo?
NCX: il maggiordomo
 A questo punto del racconto io mi recherei sul luogo del delitto alla ricerca di qualche indizio e soprattutto di qualche risposta.
A questo punto del racconto io mi recherei sul luogo del delitto alla ricerca di qualche indizio e soprattutto di qualche risposta.
Escludendo le pompe che fanno uso di ATP, tra i pochi trasportatori passivi che rimangono e che possono dare un consistente aiuto c’è lo scambiatore sodio/calcio (NCX).
Io immaginerei un ipotetico interrogatorio a questa proteina, magari in una stanza buia e fumosa.
Lei chi è?
NCX è una proteina di membrana fatta da circa 1.000 aminoacidi che è presente in tutte le cellule dei mammiferi e che fisiologicamente espelle il calcio citosolico in cambio dell’ingresso di sodio.
Da quanto tempo è in servizio?
In pratica quasi tutti gli organismi possiedono uno scambiatore del calcio, e sono tutti filogeneticamente collegati da un gene ancestrale che si è mantenuto molto conservato sia nella sua struttura che nella sua funzione. In altre parole è una proteina presente negli archeobatteri, funghi, piante, fino a tutte le cellule eucariotiche di mammifero, quindi una proteina davvero molto conservata…
Davvero notevole, ma mi dica… qual è la Sua funzione nel cervello e con chi collabora solitamente?
Sappiamo bene che, quando i neuroni si trovano a riposo, le concentrazioni ioniche sono mantenute soprattutto da pompe che fanno uso di energia sottoforma di ATP. In queste condizioni un trasportatore passivo come NCX funziona relativamente poco, poiché ha una bassa affinità per il calcio e per il sodio. Tuttavia le condizioni cambiano drasticamente dopo l’eccitazione neuronale, ovvero quando le concentrazioni di calcio citosolico aumentano improvvisamente a dismisura, le pompe si saturano e non riescono a riportare la cellula alle condizioni ioniche di riposo. In queste circostanze entrano in funzione NCX e proteine simili che hanno una bassa affinità per gli ioni, ma possono trasportarne enormi quantità in pochi istanti.
In pratica NCX espelle uno ione calcio mediante scambio con tre ioni sodio che entrano nella cellula, (proprio da questo deriva il suo nome).
Quindi Lei è specializzato nelle condizioni di ‘emergenza’, ovvero quando le pompe non riescono a mettere ordine… cosa mi sa dire riguardo all’ipossia? cosa stava facendo in quei momenti?
La risposta sarebbe ovvia. NCX stava espellendo il calcio dalle cellule sfruttando l’unica fonte di energia disponibile al momento ovvero il gradiente del sodio.
Perché?
Come già abbiamo accennato nei post precedenti il calcio è un ottimo segnale citosolico, ma quando supera certi livelli può causare disastri, quindi l’azione di NCX è in linea con le aspettative.
Ha visto qualcosa di strano in quei ‘momenti’? Può dirmi qualcosa a tal riguardo?
Quello che NCX ha visto è che la pompa del calcio in una prima fase era efficiente e riusciva a mantenere le concentrazioni di calcio citosolico a livelli estremamente bassi, ma riusciva ad espellere solo pochi ioni alla volta. Ad un certo punti si stava accumulando il calcio, la pompa è andata subito in saturazione e non riusciva ad espellere abbastanza ioni… poi è cominciata a mancare l’energia e l’efficienza di estrusione si è ridotta sempre di più. Si stava accumulando calcio citosolico oltre i normali livelli e tempi sopportabili per il neurone, per cui NCX è entrato in funzione ed ha espulso fino ad oltre 10.000 volte più ioni calcio nell’unità di tempo rispetto alla pompa in presenza di ATP, un fenomeno insomma.
…e cosa sa dirmi su cosa sia successo negli ultimi ‘istanti di agonia’? Alla fine è riuscito a tenere sotto controllo il calcio?
Effettivamente ci è riuscito parzialmente, poiché durante l’ipossia le concentrazioni di calcio si sono mantenute più o meno stabili per quanto fosse possibile farlo senza utilizzare ATP, e soprattutto fatto in così poco tempo… successivamente al ritorno dell’ossigeno tutto è tornato ad una apparente normalità; il livello di calcio citosolico è tornato nel suo normale range di concentrazioni citosoliche, quindi tutto ok, passata la tempesta è stato ovvio pensare che il peggio era oramai passato. Tuttavia, dopo un po’ qualcosa è cominciato ad andare sempre peggio, ci sono stati degli sbalzi di calcio improvvisi sempre più gravi, e la cellula si è resa conto ad un certo punto che non era possibile recuperare la situazione e si è arrivati all’inevitabile. Quei momenti sono stati talmente turbolenti che non è stato possibile capire cosa stesse succedendo.
Uhmm.. Per ora l’interrogatorio è finito, e diciamo che siamo soddisfatti delle informazioni raccolte…
Riepilogando, stiamo parlando di una proteina molto conservata, al che se ne potrebbe dedurre che il suo ruolo sia fondamentale per la sopravvivenza; insomma sembra interessante, ma purtroppo non sembra essersi aperta alcuna strada per noi. Praticamente non ci ha detto nulla.
C’è un’altra cosa…
 Ritornando in ufficio c’è una cosa che non quadra… questo trasportatore passivo dove ha trovato tutta questa energia per espellere una quantità di calcio ionico così colossale? Una pompa del calcio consuma circa 1 ATP per 1 ione calcio, possibile che NCX abbia lavorato gratis contro ogni legge della termodinamica? In altre parole quanto è costato alla cellula questo ‘servizio’?
Ritornando in ufficio c’è una cosa che non quadra… questo trasportatore passivo dove ha trovato tutta questa energia per espellere una quantità di calcio ionico così colossale? Una pompa del calcio consuma circa 1 ATP per 1 ione calcio, possibile che NCX abbia lavorato gratis contro ogni legge della termodinamica? In altre parole quanto è costato alla cellula questo ‘servizio’?
Ovviamente NCX ha sfruttato il gradiente di sodio tra l’ambiente extracellulare e quello intracellulare, ed in questo modo ha potuto espellere il pericoloso calcio dalla cellula scambiandolo con l’innocuo sodio…
Ma cosa succede a tutto quel sodio che NCX ha fatto entrare nella cellula e che non può essere espulso dalla pompa sodio/potassio?
Se sono stati necessari 3 ioni sodio per espellere ciascuno ione calcio, facendo dei semplici calcoli, a naso direi che nella cellula si sarà accumulato tanto di quel sodio da innescare altri meccanismi, ad esempio alterare il potenziale di membrana.
Se questo fosse vero la depolarizzazione causerebbe l’attivazione della cellula, con rilascio di neurotrasmettitori e conseguenze da definire. Sicuramente potremmo parzialmente spiegare l’ipereccitabilità, il calcio che rientra nuovamente nelle cellule e le onde di eccitazione neuronale che si espandono dal core ischemico.
La situazione non è molto chiara, e tornando alla centrale io darei un’occhiata allo schedario delle fedine penali, www.pubmed.gov , in cerca di cosa si sappia in giro di questo ‘maggiordomo’.
Da una rapida occhiata possiamo vedere che è correlato con numerosi meccanismi, NCX si lega con pompe e trasportatori ed esalta alcune caratteristiche dei canali ionici. Però qualcosa è più importante di tutto, è stato visto correlato con l’ischemia cardiaca; leggendo bene possiamo vedere che l’uso di farmaci che inibiscono l’attività di NCX diminuisce l’estensione della morte del miocardio in seguito all’infarto.
L’ipotesi è che la cellula si sia talmente indebitata di energia durante l’ipossia che al ripristino delle condizioni ottimali non ce n’è abbastanza per ristabilire il gradiente di sodio e reimpostare le condizioni di riposo. Un giro vizioso che può portare solo al disastro, come aver chiesto dei soldi ad uno strozzino.
Una crepa sul vetro cristallino di NCX: Calunnie?
 Uhmm… Forse calunnie, leggendo bene qua e là i farmaci utilizzati per inibire NCX non sono molto specifici, agiscono anche su altri canali; magari NCX è stato coinvolto in qualcosa di più grande ed è stato usato come capro espiatorio. Improbabile che una proteina così letale possa essere conservata per milioni di anni durante l’evoluzione se non migliori sensibilmente il fitness dell’organismo.
Uhmm… Forse calunnie, leggendo bene qua e là i farmaci utilizzati per inibire NCX non sono molto specifici, agiscono anche su altri canali; magari NCX è stato coinvolto in qualcosa di più grande ed è stato usato come capro espiatorio. Improbabile che una proteina così letale possa essere conservata per milioni di anni durante l’evoluzione se non migliori sensibilmente il fitness dell’organismo.
Per dare una prova decisiva possiamo utilizzare, come tutti voi sapete, la prova del nove… un topo transgenico knock-out per NCX e verificare cosa succede.
In questo modello, infatti, se non ci sono variazioni dell’espressione degli altri canali/trasportatori c’è la massima specificità dell’inibizione di questa proteina… e quindi potremmo ufficialmente capire se si tratta di una proteina così cattiva.
Andiamo in lab e chiediamo di sviluppare il topo knock-out. Passano anni e qui il primo intoppo, il topo muore durante l’embriogenesi per mancato battito cardiaco. Si tratta di una scoperta senz’altro interessante ma sono anche anni di lavoro buttati al vento senza una risposta. Rifare tutto il lavoro daccapo e passare altri anni a sviluppare un altro topo? Uhmm…
Qualcuno ha suggerito una soluzione da fantascienza che potrebbe risolvere la situazione, ovvero utilizzare un virus in grado di infettare i cardiomiociti dell’embrione knock-out ed inserire in queste cellule il cDNA di NCX in maniera transiente… insomma abbastanza per attivare il battito cardiaco, poi successivamente l’espressione calerà di nuovo quando il topo non sarà più infettato.
Lo sviluppo della metodologia ha impiegato un paio di anni con risultati sconfortanti, il risultato è stato che l’espressione transiente di NCX nei cardiomiociti non serve a nulla. La mancanza di NCX è fondamentale per la vita dell’animale, probabilmente è necessaria l’espressione anche in altri tessuti (es le cellule pacemaker del cuore, di tipo nervoso), oppure è necessaria una espressione ancora più precoce della proteina, magari quando non si è ancora formato il primo abbozzo di cuore.
Disperati, si è ricorsi a strategie farmacologiche sempre più complesse, ma i risultati sono stati discordanti e dubbi; mancano sempre di selettività e specificità.
Il volo Pindarico
 Le cose, da allora, non sono andate molto avanti, le pubblicazioni si sono rincorse tra di loro in un misto di ripetizioni e staccate con farmaci sempre più specifici e potenti. A questi articoli facevano seguito altri che descrivevano dell’effetto di queste sostanze sulla circolazione, ipertensione, inibizione di canali del calcio, respirazione mitocondriale, disaccoppiamenti mitocondriali etc etc.
Le cose, da allora, non sono andate molto avanti, le pubblicazioni si sono rincorse tra di loro in un misto di ripetizioni e staccate con farmaci sempre più specifici e potenti. A questi articoli facevano seguito altri che descrivevano dell’effetto di queste sostanze sulla circolazione, ipertensione, inibizione di canali del calcio, respirazione mitocondriale, disaccoppiamenti mitocondriali etc etc.
Tuttavia per fare una buona ricerca c’è bisogno di determinazione, genialità ed anche un po’ di fortuna, tutte caratteristiche ben rappresentate nel padre di NCX, Kenneth Philipson, quando a sorpresa decide di intraprendere un nuovo e più Pindarico volo, investendo diversi anni nella generazione di un nuovo topo knock-out per NCX, ma questa volta condizionato (tecnica Cre/LoxP). Si tratta di una tecnica citata già più volte e che funziona bene, in poche parole il topo nascerà con una normale espressione di NCX in tutto l’organismo, poi ad un certo punto l’enzima Cre, come una bomba ad orologeria, eliminerà il gene di NCX solo nei cardiomiociti e darà un topo adulto privato improvvisamente di NCX.
Per i più curiosi il meccanismo sfrutta il cambio della catena pesante della miosina dei cardiomiociti subito dopo la pubertà. In questi topi transgenici insieme al promotore della catena pesante della miosina c’è una ricombinasi che andrà a distruggere il gene ncx causando un knock-out tessuto e tempo specifico.
Non vi dico del rischio che il topo muoia proprio quando la proteina verrà a mancare e vanificare ancora una volta il lavoro di anni di sacrifici.
Passarono degli anni e finalmente eravamo arrivati vicino al fatidico momento, la nascita del primo topo transgenico. Da quel momento devo dire che c’è stata una lunga agonia misto di silenzio ed impazienza aspettando quel fatidico momento in cui un topolino che ha in sé tutte le promesse di questo mondo deve passare per quell’unico istante in cui diventerà knock-out e dimostrerà al mondo se è possibile vivere senza una specifica proteina cardiaca.
Purtroppo capita anche di affezionarsi ad un animale che vivendo darà inconsapevolmente un enorme contributo alla ricerca. I giorni passavano ed il topo alla sua maturità sessuale era ancora vivo e vitale, le analisi non hanno dimostrato anomalie cardiache e tutto procede come nulla fosse. Così è stato anche per le nidiate successive e la biochimica ha dato l’ok, questi topi adulti hanno un knock-out cardiaco. Si decide di fare l’ischemia cardiaca e il risultato è stato sconcertante. La mancanza di NCX nel cuore provoca un’entità del danno al miocardio pari al 50% circa rispetto ai topi wild-type.
NCX è sicuramente colpevole… un fulmine nel cielo sereno, una pubblicazione che cambierà definitivamente la storia di questo trasportatore.
Su questo modello animale sono stati poi tentati tantissimi esperimenti, soprattutto con quei farmaci così potenti e specifici per NCX; i risultati hanno dimostrato in maniera incontrovertibile che gli effetti ottenuti erano dovuti all’azione su altre proteine, è stato solo un caso che l’uso di queste sostanze dimostrano gli stessi effetti del knock-out per NCX.
Quello che succede al cuore succede anche al cervello?
 Analisi su analisi in diverse salse hanno dimostrato che questa proteina è fondamentale per alcuni meccanismi cardiaci e non solo, ma sicuramente esalta anche il danno ischemico al miocardio. E’ una circostanza difficile da spiegare in termini evoluzionistici e non è possibile capirne a fondo il meccanismo esatto.
Analisi su analisi in diverse salse hanno dimostrato che questa proteina è fondamentale per alcuni meccanismi cardiaci e non solo, ma sicuramente esalta anche il danno ischemico al miocardio. E’ una circostanza difficile da spiegare in termini evoluzionistici e non è possibile capirne a fondo il meccanismo esatto.
Qualcuno fa notare che sia l’eccesso di ioni sodio durante il lavoro di NCX a causare danno per osmosi; tre ioni sodio per miliardi di ioni calcio determinerebbero uno squilibrio osmotico che liserebbe la membrana cellulare formando prima delle bolle sulla superficie e poi la rottura fino alla morte.
Ovviamente la trasposizione al cervello è immediata, se fa male al cuore potrebbe far male anche ai neuroni?
La situazione non è semplice, abbiamo diverse opzioni per verificare questa ipotesi e nessuna di queste è facile.
L’esperimento più determinante potrebbe essere, come al solito, la generazione di un knock-out per NCX nel cervello, però si corre nuovamente il rischio di un nuovo tonfo in acqua, poiché potrebbe mancare l’embriogenesi del SNC e quindi aborto precoce. Se questo dovesse avvenire avremmo speso tempo e denaro inutilmente, per non parlare delle sofferenze indotte sugli animali.
D’altra parte fare dei knock-out tessuto specifico, soprattutto per il cervello, è difficile, lungo e dispendioso; per ora accantoniamo l’idea fino a che non sia strettamente necessario.
Potremmo ricorrere a dei saggi alternativi per chiarire la situazione, e magari li vediamo nella prossima puntata.
Conclusione
Si potrebbe definire serendipità: cercare un ago in un pagliaio e trovarci la figlia del contadino (Julius H. Comroe).
Stavamo brancolando nel buio in cerca di prove e ci siamo scontrati con un pregiudicato per il danno cardiaco ischemico camuffato da semplice faccendiere delle pulizie da calcio.
Nelle prossime puntate analizzeremo meglio il personaggio, il suo ruolo nel cuore e poi nel cervello, cercheremo nuove prove a cui ovviamente farà seguito il ‘processo’ per concorso in neuro-omicidio.
Alla prossima
Tags:
Animali transgenici,
Calcio,
Cre/LoxP,
Ictus,
Ischemia Cerebrale,
NCX,
Neuroni,
Neuroscienze,
PMCA,
pompe,
Potenziali d'azione,
sodio
4 settembre 2009 - 1:00 pm
Preambolo
Finalmente le tanto meritate vacanze sono iniziate anche per me, e colgo l’occasione per finire finalmente questo post in elaborazione oramai da tanto tempo, come al solito cortesemente corretto da Valentina. Qui descriverò un argomento abbastanza lungo, difficile e ‘spigoloso’ per i profani ed esperti, anche se penso che tutti lo conoscono almeno un po’ per sentito dire.
Parleremo dell’olfatto, un argomento non facile da raccontare in un post divulgativo senza ‘smussare’ qua e là il mosaico di teorie e di esperimenti che sono stati fatti fino ad ora.
L’Olfatto: Alcuni dettagli ovvi

Come al solito mi servirò inizialmente di qualche punto di riferimento per metterci d’accordo ed inizierò dagli odori che sono causati, come tutti voi sapete, da molecole sprigionate dalle sostanze e disperse nell’aria che respiriamo, dove raggiungono il nostro naso. L’altro punto di riferimento utile si trova subito dietro il naso e sopra la volta della nostra cavità buccale dove passano tutte le molecole che noi respiriamo. E’ una cavità rivestita da una mucosa di circa 10 cm2 che attraverso la solubilizzazione, la dispersione, l’adsorbimento e quant altro, ferma una porzione delle molecole che si trovano nello stadio aeriforme nella cavità nasale e le disperde nel fluido mucoso. Qui le molecole possono incontrare una o più cellule recettoriali olfattive (ORC), in un uomo adulto se ne contano circa 10-20 milioni, ricche di propagini dette ciglia e di proteine dette recettori olfattivi (da qui chiamate Odorant Receptor OR).
I OR hanno il compito ‘legare’ in maniera più o meno specifica alcuni gruppi funzionali di queste molecole presenti nel fluido mucoso, ed innescare una cascata di eventi che si amplifica fino ad attivare la cellula recettrice e scatenare la propagazione del ‘segnale odoroso’. Il cervello, a sua volta, provvederà ad interpretare il segnale in diversi stadi con una serie di meccanismi molto complessi. Per dettagli ed approfondimenti potete guardare questo link.
Fin qui il tutto è quasi scontato ed ovvio, però dalla teoria alla pratica c’è una notevole differenza, vi dico subito che ancora oggi ci sono vari lati oscuri che cercherò di descrivervi in parole semplici, portandovi ai problemi scientifici in maniera intuitiva per quanto sia nelle mie capacità.
Quanti odori esistono?
 Come penso molti di voi possono intuire, esiste un numero inimmaginabile di odori, e la maggioranza di questi è causato da un mix di ‘odori primari’ in diversi rapporti, ma a complicare la situazione c’è che una molecola odorosa può agire su decine di recettori diversi con diversa specificità. I OR dei composti aminici, ad esempio, riconoscono solamente l’azoto primario, secondario o terziario con diversa efficacia, per cui gli odori di questi composti non possono essere discriminati con facilità e sembrano tutti molto simili. C’è da dire però che nonostante questa piccola sovrapposizione di segnali si possono discriminare con elevata sensibilità circa 10.000 odori diversi.
Come penso molti di voi possono intuire, esiste un numero inimmaginabile di odori, e la maggioranza di questi è causato da un mix di ‘odori primari’ in diversi rapporti, ma a complicare la situazione c’è che una molecola odorosa può agire su decine di recettori diversi con diversa specificità. I OR dei composti aminici, ad esempio, riconoscono solamente l’azoto primario, secondario o terziario con diversa efficacia, per cui gli odori di questi composti non possono essere discriminati con facilità e sembrano tutti molto simili. C’è da dire però che nonostante questa piccola sovrapposizione di segnali si possono discriminare con elevata sensibilità circa 10.000 odori diversi.
Ciò premesso, consentitemi da questo punto in poi di semplificare e di concentrarci esclusivamente sugli ‘odori primari‘ che sono riconosciuti quasi esclusivamente da un solo tipo di OR e che danno una sensazione odorosa molto precisa.
Cosa c’è di difficile?
 Nel mondo animale, il non saper distinguere l’odore di una preda dall’odore del proprio predatore fa la differenza tra fare una buona colazione ed essere la colazione di qualcun altro. Anche riconoscere l’odore delle cose che si possono mangiare da quelle che è meglio evitare è fondamentale per la sopravvivenza, quindi i mammiferi durante l’evoluzione hanno accumulato più di 1.000 geni che sovraintendono il più misterioso dei 5 sensi. In pratica più del 3% del genoma dei mammiferi è deputato alla percezione degli odori, e dato che questi recettori possono riconoscere anche più tipologie di molecole con diversa affinità determinando una combinazione di interazioni intermedie, questo amplifica esponenzialmente il ventaglio di sensazioni che possono dare le molecole presenti nell’aria.
Nel mondo animale, il non saper distinguere l’odore di una preda dall’odore del proprio predatore fa la differenza tra fare una buona colazione ed essere la colazione di qualcun altro. Anche riconoscere l’odore delle cose che si possono mangiare da quelle che è meglio evitare è fondamentale per la sopravvivenza, quindi i mammiferi durante l’evoluzione hanno accumulato più di 1.000 geni che sovraintendono il più misterioso dei 5 sensi. In pratica più del 3% del genoma dei mammiferi è deputato alla percezione degli odori, e dato che questi recettori possono riconoscere anche più tipologie di molecole con diversa affinità determinando una combinazione di interazioni intermedie, questo amplifica esponenzialmente il ventaglio di sensazioni che possono dare le molecole presenti nell’aria.
La chiave di volta per ottenere un buon olfatto è sicuramente il collegamento tra le cellule recettoriali odorose (ORC) ed il cervello, ovvero quel meccanismo che consente di poter capire quale specifico OR è stato attivato. Si tratta di un meccanismo per nulla banale, e come punto di riferimento, possiamo considerare l’esempio del gusto, dove i recettori cellulari sono generati in base alla localizzazione sulla superficie della lingua. Nel cervello si forma una sorta di correlazione tra aree specifiche corticali ed aree della lingua denominata ‘mappa sensoriale‘. A questo consegue che è possibile percepire il salato, l’amaro, il dolce ed l’acido in base a quale zona della lingua è stata stimolata maggiormente.
Possiamo trasportare questa ipotesi nell’olfatto, ed immaginare che l’area in cui si trovano le ORC determina anche il set di recettori da esprimere. Ipotizziamo che ciascuna cellula recettrice dell’olfatto possa esprimere un centinaio o più OR localizzati in diverse aree della mucosa nasale. Ogni area in cui vi sono le ORC potrebbe essere correlata ad una zona del cervello a cui corrisponderebbero determinate sensazioni odorose.
Quanti recettori per cellula?
 Sapere quanti tipi di recettori sono presenti per cellula è fondamentale per capire quante aree ci dovremmo aspettare di trovare e per verificarlo potremmo ricorrere a tecniche avanzatissime di in situ hybridization, e di retrotrascrizione ed amplificazione per PCR su singola cellula. Ovviamente non sono tecniche facili e nemmeno tanto diffuse, ma gli esperti sono riusciti a dimostrare con questi esperimenti che ogni ORC esprime solamente un singolo OR.
Sapere quanti tipi di recettori sono presenti per cellula è fondamentale per capire quante aree ci dovremmo aspettare di trovare e per verificarlo potremmo ricorrere a tecniche avanzatissime di in situ hybridization, e di retrotrascrizione ed amplificazione per PCR su singola cellula. Ovviamente non sono tecniche facili e nemmeno tanto diffuse, ma gli esperti sono riusciti a dimostrare con questi esperimenti che ogni ORC esprime solamente un singolo OR.
Una cosa simile avviene durante il differenziamento cellulare, dove la combinazione di alcuni fattori trascrizionali decide l’attivazione di meccanismi sempre più specializzati che ‘bloccano’ l’espressione specifica di determinati geni. Questo meccanismo, definito ‘deterministico’, è quello maggiormente utilizzato durante la specializzazione cellulare nel nostro organismo. Potremmo ipotizzare un meccanismo simile per le ORC in cui dalla combinazione di alcuni fattori trascrizionali si determina l’attivazione dell’espressione di un singolo OR.
Verifica della Teoria Deterministica
 Secondo questa teoria la combinazione casuale o pseudocasuale di fattori trascrizionali per esprimere un singolo OR non può essere disturbata dalla coespressione di un OR transgenico scelto da noi. Per verificare questa teoria ‘deterministica‘, quindi, possiamo generare un topo transgenico in cui alcune ORC esprimono in maniera forzata un determinato OR scelto da noi e valutare se c’è coespressione.
Secondo questa teoria la combinazione casuale o pseudocasuale di fattori trascrizionali per esprimere un singolo OR non può essere disturbata dalla coespressione di un OR transgenico scelto da noi. Per verificare questa teoria ‘deterministica‘, quindi, possiamo generare un topo transgenico in cui alcune ORC esprimono in maniera forzata un determinato OR scelto da noi e valutare se c’è coespressione.
Il risultato è interessante, non c’è alcuna sovrapposizione di segnali tra il OR espresso forzatamente da noi ed un qualsiasi altro recettore olfattivo endogeno. In pratica l’espressione forzata del nostro OR transgenico non permette di esprimere un qualsiasi altro OR endogeno, e se si tenta di generare un topo transgenico con una espressione forzata di due OR diversi nella stessa ORC, queste muoiono per apoptosi. Questi dati non sono di certo a supporto per la teoria deterministica, evidentemente la scelta del recettore olfattivo è un meccanismo molto più complesso. Ad aggiungere benzina sul fuoco c’è un’altra prova interessante, ovvero le ORC possono cambiare più volte il recettore odoroso espresso prima di prendere contatto con il cervello (maturazione cellulare). La teoria deterministica è molto fallace con questi risultati, poco probabile che sia quella buona.
La Teoria Stocastica
 Un’altra teoria che si è fatta strada nel tempo è basata sulla casualità della scelta del OR espresso (teoria stocastica). Per capirci immaginiamo un fattore trascrizionale unico che sia in grado di legare il promotore di tutti i geni dei OR e di consentirne l’espressione; tecnicamente può legarsi ad un solo OR e quindi può esprimere solo quello. Se il fattore trascrizionale non è molto efficiente nell’esprimere un OR si potrebbe spiegare come mai una ORC cambia OR nei primi stadi pur seguendo sempre la regola di esprimere un solo OR alla volta. In seguito, quando un OR espresso dà un forte segnale di funzione (feed-back) il fattore trascrizionale si fissa sul gene che sta trascrivendo fino allo stadio di maturazione.
Un’altra teoria che si è fatta strada nel tempo è basata sulla casualità della scelta del OR espresso (teoria stocastica). Per capirci immaginiamo un fattore trascrizionale unico che sia in grado di legare il promotore di tutti i geni dei OR e di consentirne l’espressione; tecnicamente può legarsi ad un solo OR e quindi può esprimere solo quello. Se il fattore trascrizionale non è molto efficiente nell’esprimere un OR si potrebbe spiegare come mai una ORC cambia OR nei primi stadi pur seguendo sempre la regola di esprimere un solo OR alla volta. In seguito, quando un OR espresso dà un forte segnale di funzione (feed-back) il fattore trascrizionale si fissa sul gene che sta trascrivendo fino allo stadio di maturazione.
E’ una teoria che funziona e che spiega anche i risultati dei topi transgenici; il OR transgenico blocca l’espressione di altri recettori attraverso un feed-back abberrante. Però, come al solito la teoria va convalidata, e c’è l’imbarazzo della scelta sul come; una prova schiacciante potrebbe derivare dall’eliminazione del feed-back recettoriale. In particolare potremmo alterare un gene OR in modo tale da codificare un recettore non funzionante pur conservandone la struttura genica.
I risultati dimostrano che il topo transgenico non esprime mai un OR non funzionante, probabilmente proprio per la mancanza del feed-back del recettore maturo necessario per fissare la scelta. Per esserne sicuri, è stata effettuata una controprova per dimostrare che le ORC tentano di esprimere il OR non funzionante, e che solo successivamente cambiano la scelta su un altro gene OR che funzioni. Per dimostrarlo si è generato un topo transgenico in cui l’espressione anche transiente del recettore non funzionante provoca un danno irreversibile al DNA della stessa cellula (tecnica Cre/LoxP), ed i risultati hanno mostrato che le ORC scelgono il OR transgenico e non funzionante con la stessa probabilità di tutti gli altri OR, sebbene questa scelta sia cambiata prima della maturazione cellulare per mancanza di feed-back. Un’altra prova conclusiva e schiacciante è che la generazione di un topo trangenico che esprime un OR esogeno e non funzionante non disturba l’espressione dei OR endogeni. Questo dimostra che è la funzione di un OR a bloccare l’espressione dei OR endogeni, non la struttura e l’espressione dei geni OR endogeni.
La spina nel fianco per la Teoria Stocastica
La teoria stocastica fino ad ora ha sempre soddisfatto tutti i dati sperimentali ottenuti, ma ciononostante ha un punto debolissimo. Questa teoria è retta dalla possibilità di poter innescare la trascrizione di qualsiasi dei 1.000 geni dei OR da uno o pochi fattori trascrizionali, e questo sarebbe possibile solo nel caso in cui i geni OR presentino una sequenza consenso che li identifichi nel genoma. Ebbene, nonostante molti ricercatori si siano impegnati nell’analisi di omologie di sequenze tra i geni degli OR, i risultati ottenuti sono stati alquanto deludenti; con i dati attuali si potrebbero raggruppare non più di una decina di geni degli OR per volta tirando in ballo meccanismi di riconoscimento improbabili.
E se fossero dei Linfociti?
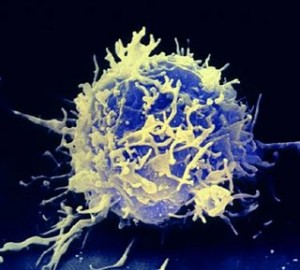 Se ci pensate, esiste un meccanismo di scelta molto simile che avviene nei linfociti. Queste cellule, però, non decidono l’anticorpo da esprimere in base a fattori trascrizionali, ma attraverso una ricombinazione genetica guidata. Si tratta di una piccola deviazione della teoria stocastica ed è anche risolutiva.
Se ci pensate, esiste un meccanismo di scelta molto simile che avviene nei linfociti. Queste cellule, però, non decidono l’anticorpo da esprimere in base a fattori trascrizionali, ma attraverso una ricombinazione genetica guidata. Si tratta di una piccola deviazione della teoria stocastica ed è anche risolutiva.
Come al solito dobbiamo convalidare tale teoria… ed escludiamo subito la proposta di sequenziare l’intero genoma di singole cellule, sarebbe difficilissimo e ci vorrebbero tanti anni! Possiamo ricorrere ad un trucco chiamato FISH (fluorescent in situ hybridization), ovvero rendere fluorescente una sonda ad RNA verso un introne di un OR. In questa tecnica non è possibile valutare una ricombinazione genica in maniera diretta, tuttavia è possibile localizzare dove inizia la trascrizione di un determinato gene all’interno del nucleo e valutare se, in seguito ad una ricombinazione, cambia posizione. I risultati, alquanto discutibili, dimostrano che il sito di inizio della trascrizione avviene sempre nello stesso punto del nucleo e del genoma, quindi niente ricombinazione, ma c’è una novità inaspettata; la trascrizione di un OR proviene solamente da un singolo allele.
Sbrogliare la matassa di informazioni non è mai facile

Spesso nella ricerca è importante definire delle ipotesi e porsi le domande giuste, ovvero cercare di identificare la cosa più importante di un meccanismo e trarne quante più informazioni possibili per verifica e deduzione. Nel nostro caso la codifica di un singolo allele, cioè solo 1 delle due copie genetiche di un OR, è ancora in linea con la teoria della ricombinazione genetica, poiché se è vero che la scelta è casuale, questa non può avvenire in entrambi gli alleli fratelli allo stesso modo. Inoltre se l’inizio della trascrizione avviene sempre nello stesso punto, questo non esclude che tutto il resto del DNA (es il promotore) possa essere stato ricombinato.
L’ipotesi che ne scaturisce è questa: La cellula sceglie un OR da esprimere in modo casuale, in mancanza di un feed-back funzionale cambia scelta, in seguito, alla maturazione cellulare la scelta diventa definitiva mediante ricombinazione di un promotore o di segnali a monte dell’OR scelto. Questa ipotesi potrebbe spiegare come mai l’espressione forzata di un recettore esogeno possa bloccare l’espressione dei recettori endogeni; probabilmente la proteina inserita provoca un feed-back che innesca una ricombinazione abberrante del DNA nei OR endogeni. La teoria per ora tiene ma con le parole non si dimostra mai niente, è fondamentale convalidare la teoria e questa volta non è per nulla facile evidenziare tante piccole ricombinazioni in singole cellule di 20 micron di diametro circa.
Come dimostrare una ricombinazione che si possa trovare in un qualsiasi punto del genoma? In questo caso il test di validazione è non semplicissimo. L’idea è che la ricombinazione del DNA in una ORC provocherebbe il blocco dell’espressione di un determinato OR in tutte le condizioni, come avviene per un linfocita. Se da questo DNA ricombinato si clonasse il topo stesso da cui deriva… l’animale che risulterebbe dovrebbe esprimere solo un OR, poiché il suo DNA è già ricombinato in maniera irreversibile. I risultati sono stati scioccanti, il topo che ne risulta è perfettamente sano e ha tutto l’apparato olfattivo intatto e funzionante come in un qualsiasi wild-type. Nonostante l’analisi di circa 100 kb a monte ed a valle del gene incriminato non c’è stata nessuna modifica genetica o epigenetica.
Basta un soffio ed il castello crolla
 Certamente la ricombinazione è da scartare ma fino ad ora niente ha smentito la casualità della scelta del OR. Tuttavia un gruppo di ricerca ha recentemente messo in discussione anche questa ipotesi granitica.
Certamente la ricombinazione è da scartare ma fino ad ora niente ha smentito la casualità della scelta del OR. Tuttavia un gruppo di ricerca ha recentemente messo in discussione anche questa ipotesi granitica.
L’idea di fondo è la seguente… Se è vero che la cellula sceglie casualmente un gene su circa 1.000, e di questo solo 1 allele, ne consegue che la scelta è di 1 sui 2.000 alleli disponibili. Se riuscissimo ad inattivare solo 1 di questi 2.000 alleli, ad esempio in modo tale che esprima irreversibilmente EGFP (tecnica Cre/loxP), potremmo rendere fluorescenti le cellule che hanno ‘cambiato idea’ per mancanza di feed-back e verificare quale altro gene sceglie dei 1.999 rimanenti.
Il risultato, ancora una volta, è assolutamente strabiliante. Il topo transgenico presenta una coespressione di EGFP solo con il suo allele funzionante corrispondente. In poche parole l’espressione di EGFP, come previsto, non dà feed-back positivo per cui la cellula cambia OR da esprimere; ma la seconda scelta non è per niente casuale, qualcosa guida la scelta sull’allele di ‘backup’ presente sul cromosoma fratello e non sugli altri 1.998 alleli rimanenti. Come potrebbe la cellula riconoscere in modo specifico l’altro allele se la scelta è basata solo sulla casualità? Qualcosa non quadra, ed in questo modo la casualità che ha retto la teoria stocastica fino ad ora è stata, almeno parzialmente, distrutta in un soffio.
L’olfatto che guida l’assone durante il lungo cammino
 L’ultima domanda è ‘Cosa succede con il collegamento al cervello quando forziamo una cellula ORC ad esprimere un recettore specifico scelto da noi?’. Gli esperimenti mostrano che il collegamento cervello-recettore è perfetto, quindi ne consegue che il collegamento è basato solo sull’OR espresso.
L’ultima domanda è ‘Cosa succede con il collegamento al cervello quando forziamo una cellula ORC ad esprimere un recettore specifico scelto da noi?’. Gli esperimenti mostrano che il collegamento cervello-recettore è perfetto, quindi ne consegue che il collegamento è basato solo sull’OR espresso.
Ma quando questa scelta cambia all’improvviso?
Per rispondere a questa domanda un gruppo di ricercatori ha tentato di cambiare il recettore scelto dalla cellula poco prima che questa riesca ad ‘agganciarsi’ al cervello (maturare), attraverso un gene OR esogeno ed inducibile.
In questo topo transgenico le ORC scelgono un recettore endogeno in un modo apparentemente casuale, e cominciano la propagazione dell’assone verso il cervello cercando la zona giusta per formare sinapsi. Durante questa fase si può innescare l’espressione del recettore transgenico con il conseguentemente spegnimento del recettore endogeno…
La cellula ancora immatura, come abbiamo visto, si ‘adatta’ al nuovo recettore, ma si aggancerà anche alla zona cerebrale giusta? La risposta è incredibilmente sì. il collegamento e la funzione del recettore è perfetto nonostante il cambio recettoriale durante la formazione dell’assone. Tuttavia, se si cerca di cambiare la scelta dell’OR espresso dopo la maturazione della ORC, si provoca una abberrazione che innesca apoptosi.
Come è possibile che un OR possa guidare la scelta della regione cerebrale giusta a cui ‘agganciarsi’ senza avere altri 1.000 geni deputati al riconoscimento dei diversi OR da parte del cervello?
Qualcuno ha suggerito un’ipotesi alquanto affascinante, secondo cui un OR si trovi alla testa dell’assone durante la fase di elongazione, guidandolo verso il corretto punto di aggancio al cervello come farebbe un cane da tartufo a portarci verso questo prezioso tubero in un intero bosco.
Teoria affascinante e stravagante, tuttavia ancora insoluta ed in cerca di qualcuno che la convalidi o la controbatta con esperimenti, o con ipotesi più semplici.
Conclusione
In questo lungo post abbiamo messo sul piatto tutto quello che è noto sull’olfatto senza uscirne fuori con una teoria solida in grado di spiegare tutti i dati sperimentali. Per chi fa ricerca questo risultato è il pane quotidiano poiché non si seguono mai strade battute, si cerca sempre di crearne nuove, con nuove ipotesi, nuove verifiche e nuove deduzioni che porteranno ad altre ipotesi che si spera siano migliori delle precedenti e più vicine alla verità.
Tutt’ora ci sono gruppi di ricerca che analizzano le seguenze di DNA dei recettori OR cercando qualcosa in comune; analisti in cerca di modifiche epigenetiche in questi clusters genomici; cacciatori di nuovi meccanismi cellulari; esperti di transgeni che tentano nuove e più affascinanti teorie, a volte anche bizzarre… e poi ci sono ricercatori che provano a dare un senso a questo puzzle di dati disarmonici. Il tutto per svelare un mistero che dura da tanti anni oramai.
Non vi è dubbio che ci sono persone che provano un certo fascino nel partecipare a questa continua caccia alla soluzione del problema strato dopo strato, tirando fuori teorie sempre più complesse ed affascinanti, ed a volte come in questo caso si tirano fuori addirittura nuovi meccanismi che si ignoravano fino a poco tempo fa.
Un in bocca al lupo a chi si addentrerà nel risolvere questo mistero anche solo per 5 minuti ed un grazie a Nico e Patrizio per l’incoraggiamento ed i consigli che mi hanno dato per la stesura di questo post.
Tags:
Animali transgenici,
Apoptosi,
Biologia molecolare,
Cellule Recettoriali,
Cre/LoxP,
fattori trascrizionali,
mappa sensoriale,
Neuroni,
neuroni olfattivi,
Olfatto,
Percezione
17 dicembre 2008 - 9:55 pm
La ricostruzione della scena del crimine
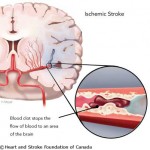 Allora, per chi non avesse seguito le puntate precedenti, abbiamo introdotto un giallo misterioso dove delle cellule del cervello umano muoiono improvvisamente in seguito ad ischemia cerebrale (icutus), mentre noi siamo la polizia scientifica molecolare nominati per cercare di spiegare cosa sia accaduto in quegli istanti e determinare chi ha causato la morte neuronale.
Allora, per chi non avesse seguito le puntate precedenti, abbiamo introdotto un giallo misterioso dove delle cellule del cervello umano muoiono improvvisamente in seguito ad ischemia cerebrale (icutus), mentre noi siamo la polizia scientifica molecolare nominati per cercare di spiegare cosa sia accaduto in quegli istanti e determinare chi ha causato la morte neuronale.
Per chi non avesse seguito le parti precedenti dia uno sguardo ad i seguenti links Ischemia Cerebrale (Parte I) Ischemia Cerebrale (Parte II)
Fino ad ora il nostro taccuino è quasi vuoto, sappiamo ancora poco e ci sono ancora tante cose da analizzare. Se fossimo degli zelanti ispettori, una delle prime cose da fare potrebbe essere ricostruire le ultime ore delle vittime per capire chi poteva trovarsi là al momento del delitto. In questo caso potremmo usare dei modelli cellulari (in vitro) o animali (in vivo) per riprodurre quello che succede nell’ictus umano. La scelta del modello non è banale, anzi è fondamentale per poter chiarire qualcosa. In genere si hanno due strade davanti ed in base a questa scelta dipenderà il livello di difficoltà che si dovrà affrontare.
La prima strada è la scelta di modelli cellulari (in vitro) che danno dei dati semplicemente misurabili ed abbastanza riproducibili; tutto sommato è un sistema semplicissimo da affrontare, ma d’altra parte ci accorgeremo presto che questi modelli sono un’eccessiva semplificazione di quello che avviene nell’uomo e che quindi ci sono anche delle notevoli limitazioni.
La seconda strada, invece, è la scelta di un modello animale (in vivo) che riproduce con molta fedeltà quello che avviene sull’uomo, ma è difficile da capire ed analizzare in tutti i suoi dettagli, proprio perché più simili al danno umano.
Ci sarebbe anche una terza strada definita ex vivo oppure colture organo tipiche, in cui si coltivano interi tessuti o parti di organi prelevati dall’animale vivo per avere una maggiore complessità rispetto alle semplici cellule, ma un vantaggio di semplificazione rispetto all’animale intero.
Le ultime ore delle vittime
Quello che si fa è prendere un certo numero di animali, ad esempio topi o ratti, ed indurre in questi l’ictus attraverso l’occlusione di una arteria cerebrale importante. Ogni animale potrebbe essere analizzato in tempi diversi così da ricostruire gli eventi che seguono l’occlusione sanguigna e precedono il danno finale.
I risultati sono interessanti, poiché è subito evidente che non tutte le cellule neuronali muoiono contemporaneamente; il volume ischemico si espande da una zona più vicina all’occlusione sanguigna fino ad arrivare ad un massimo di espansione a circa 24 ore dal danno. In ogni momento potremmo riconoscere una zona prevalentemente necrotica con poche cellule vive (core ischemico) ed una zona circostante in sofferenza che diverrà ben presto anch’essa morta (penombra ischemica).
L’onda killer
 Se dovessimo ricostruire cosa accade negli ultimi istanti di queste cellule, ci potremmo accorgere che le cellule della penombra moriranno entro qualche ora non riescono a gestire i flussi di calcio citosolico (vedi primo post). Il calcio si accumula nelle cellule poiché queste non hanno energia a sufficienza per pomparlo fuori; di conseguenza le cellule sono più facilmente eccitabili e possono attivarsi anche in momenti non opportuni, liberando neurotrasmettitori che eccitano altre cellule come un’onda di scariche elettriche longitudinali che si propagano dal centro dell’ischemia fino alla periferia del cervello. Proprio in questi momenti, ovvero poco prima della morte cellulare, si possono avere dei corto circuiti neuronali e l’avvio di sistemi di ripristino di emergenza nella metà cerebrale colpita. Questi corto circuiti generano i classici segni premonitori che si possono riassumere nell’acronimo inglese FAST
Se dovessimo ricostruire cosa accade negli ultimi istanti di queste cellule, ci potremmo accorgere che le cellule della penombra moriranno entro qualche ora non riescono a gestire i flussi di calcio citosolico (vedi primo post). Il calcio si accumula nelle cellule poiché queste non hanno energia a sufficienza per pomparlo fuori; di conseguenza le cellule sono più facilmente eccitabili e possono attivarsi anche in momenti non opportuni, liberando neurotrasmettitori che eccitano altre cellule come un’onda di scariche elettriche longitudinali che si propagano dal centro dell’ischemia fino alla periferia del cervello. Proprio in questi momenti, ovvero poco prima della morte cellulare, si possono avere dei corto circuiti neuronali e l’avvio di sistemi di ripristino di emergenza nella metà cerebrale colpita. Questi corto circuiti generano i classici segni premonitori che si possono riassumere nell’acronimo inglese FAST
- Faccia asimmetrica (ad es. una palpebra più bassa, o una bocca storta): ciascuna metà del nostro organismo è gestita da una metà cerebrale, se in una di queste ultime avvengono corto circuiti oppure entrano in funzione sistemi di emergenza, la faccia o il corpo può avere un’asimmetria.
- Arti asimmetrici: si sollevano entrambe le braccia con i palmi rivolti verso l’alto, poi si chiudono gli occhi e si mantiene questa posizione per qualche secondo, nell’ictus un braccio tende a scendere per lo stesso motivo precedente
- Suoni confusi o distorti: Se le scariche elettriche colpiscono il centro del linguaggio, il paziente potrebbe essere colto da afasia con emissione di parole confuse, suoni distorti o potrebbe pensare di parlare correttamente mentre farfuglia parole a caso.
- Tempo: se si notano anche uno solo dei sintomi precedenti non bisogna esitare, una cura tempestiva è fondamentale per una buona riuscita della terapia.
Questi sintomi, infatti, compaiono ben prima che avvenga la morte dei neuroni, quindi sono ancora del tutto reversibili se si riesce a ripristinare la circolazione cerebrale.
Il paziente potrebbe anche avere all’improvviso
- debolezza o insensibilità o comparsa di formicolii a una metà del volto, a un braccio o a una gamba oppure a tutta la metà del corpo
- oscuramento o perdita della visione da un solo occhio
- incapacità di esprimersi o di comprendere qualcuno che parla
- inspiegabile sensazione di vertigine, capogiro, sbandamento o cadute improvvise
- grave e inspiegabile mal di testa.
Se questi sintomi scompaiono entro 24 ore, al paziente verrà detto che ha avuto un Transient Ischemic Attack (TIA), cioè un attacco ischemico transitorio, in pratica un ictus minore, dovuto a una occlusione solo transitoria di un vaso arterioso.
Primo intervento
Se il paziente colpito da icuts ha la fortuna avere vicino qualcuno che sa riconoscere i sintomi e riesce a portarlo in pronto soccorso entro le 3 ore dall’occlusione dell’arteria cerebrale, allora i medici potrebbero somministrare al paziente del tPA, ovvero l’attivatore tissutale del plasminogeno, in grado di degradare il trombo che ha occluso un’arteria e ridare ossigeno alle cellule neuronali prima che sia troppo tardi. Altra alternativa altrettanto valida è inserire un palloncino nell’arteria occlusa per gonfiarlo nell’ostruzione e liberare il circolo sanguigno.
Quando invece è già troppo tardi succede un qualcosa di irreversibile o quasi. Questo impercettibile punto di non ritorno che avviene dopo le prime 3 ore nell’uomo e ben prima che incominci la morte neuronale è l’oggetto della nostra contesa.
Fino ad oggi, infatti, non esistono metodologie che riescano in qualche modo ad identificare il perché le cellule neuronali muoiano anche se ricevono ossigeno, metaboliti e sostanze trofiche, e non si riesce a capire neanche quanto sarà esteso il danno, quali cellule moriranno e soprattutto quale zone saranno interessate. Ai familiari del paziente, infatti, verrà detto che bisognerà aspettare 1-2 giorni per capire quanto esteso è il danno e quali zone del cervello interesserà.
Questo aspetto è il punto cruciale, in queste ore che precedono il danno le cellule sono vive e ci servirebbe capire perché muoiono per poi cercare disperatamente un metodo per bloccare tale procedura apparentemente irreversibile.
Analisi della scena del crimine
 Un ispettore che si trova in una scena del crimine molto complessa come quella descritta e che ha sentito la ricostruzione del danno analizzerebbe sicuramente tutta una batteria di proteine e di mRNA per capire costa stavano facendo i neuroni in quei momenti. Questa analisi ovviamente può essere fatta da una ipotetica polizia scientifica utilizzando, ad esempio, la metodica dei microarray.
Un ispettore che si trova in una scena del crimine molto complessa come quella descritta e che ha sentito la ricostruzione del danno analizzerebbe sicuramente tutta una batteria di proteine e di mRNA per capire costa stavano facendo i neuroni in quei momenti. Questa analisi ovviamente può essere fatta da una ipotetica polizia scientifica utilizzando, ad esempio, la metodica dei microarray.
I microarray sono dei piccoli chips della grandezza della punta del nostro indice con cui è possibile valutare l’aumento o la diminuzione dell’espressione dell’mRNA di tantissimi geni contemporaneamente attraverso l’uso di un estratto di RNA da un controllo ed un estratto di RNA da un trattato.
Per chi non conosce i chips può leggere qui Microarray – Wikipedia
Tecnicamente questa metodica ci consente di guardare sommariamente tra i nostri 30.000 geni, quali sono aumentati o diminuiti in seguito ad un determinato stimolo, farmaco, malattia etc etc.
Questa metodica, infatti, si addice benissimo ad avere una visione globale del problema per incominciare un percorso di indagine sui responsabili della patologia.
Noi potremmo utilizzare questa metodica per analizzare zone analoghe del cervello in un animale ischemico e confrontarlo con un animale shame-operated, ovvero un animale che ha ricevuto una procedura chirurgica simile ma che non ha avuto l’occlusione di un arteria. Questo è importante poiché dobbiamo evitare alcune interferenze dovute allo stress operatorio, ad eventuali infiammazioni o infezioni. Dall’analisi emerge che sono variati almeno 7.000 geni.
Abbiamo quindi 7.000 testimoni o potenziali imputati da valutare con attenzione singolarmente o in gruppo nel processo che si sta aprendo, a cui si dovrebbero aggiungere anche altri imputati eccellenti che non possono essere valutati con i microarray, ad esempio neurotrasmettitori, sostanze endogene, ioni, meccanismi post-traduzionali (su proteine) che possono alterare l’espressione di una proteina, e la sua funzione senza interferire in alcun modo sulla sua espressione.
Conclusione
In questo ultimo post introduttivo abbiamo presentato un piccolo bagliore della difficoltà di questo lungo ed inesauribile processo verso ignoti che causano ogni anno una invalidità più o meno grave fino alla morte di tantissime persone nei paesi industrializzati. Per utilizzare un termine moderno si potrebbe parlare di un maxi-processo in cui gli imputati sono tra loro correlate con gerarchie complesse. Come già accennato, gli imputati sono in realtà numericamente molti di più di 7.000, ma fortunatamente non li prenderemo in considerazione tutti nel nostro blog; vedremo solo alcuni personaggi perché interessanti, ambigui, fortemente sospettati, antipatici, schivi o semplicemente perché si trovava lì al momento del delitto.
Alla prossima puntata.
Tags:
Ictus,
Ischemia Cerebrale,
Microarray,
mRNA,
Neuroni
 …potrebbe essere colpa della “materia bianca”!
…potrebbe essere colpa della “materia bianca”!


 A cosa servono gli astrociti? Negli scorsi post abbiamo cercato di rispondere a questo interrogativo esaminando due opinioni opposte. Chi dice che le cellule-stella abbiano un ruolo nei processi cognitivi superiori come apprendimento e
A cosa servono gli astrociti? Negli scorsi post abbiamo cercato di rispondere a questo interrogativo esaminando due opinioni opposte. Chi dice che le cellule-stella abbiano un ruolo nei processi cognitivi superiori come apprendimento e 






 Come funziona la
Come funziona la 













 Come abbiamo visto nel precedente post, il nostro ispettore cellulare è stato improvvisamente freddato dallo scagionamento del primo imputato eccellente. La teoria iniziale non faceva una grinza e c’erano anche molti indizi pesanti contro l’accusato. Purtroppo con il tempo e con l’uso di sostanze sempre più specifiche per il blocco del fattore transcrizionale la teoria della difesa ha avuto sempre più supporto. HIF-1 non è sicuramente una proteina da mettere tra i cattivi per l’
Come abbiamo visto nel precedente post, il nostro ispettore cellulare è stato improvvisamente freddato dallo scagionamento del primo imputato eccellente. La teoria iniziale non faceva una grinza e c’erano anche molti indizi pesanti contro l’accusato. Purtroppo con il tempo e con l’uso di sostanze sempre più specifiche per il blocco del fattore transcrizionale la teoria della difesa ha avuto sempre più supporto. HIF-1 non è sicuramente una proteina da mettere tra i cattivi per l’ Pensare all’ipossia come innesco di un meccanismo che porterà a morte inevitabile per i
Pensare all’ipossia come innesco di un meccanismo che porterà a morte inevitabile per i  Se fate questa domanda ad un qualsiasi esperto nel settore vi dirà che ci sono migliaia di proteine che fanno ‘ordine’ tra i diversi ioni, e sono divise in famiglie, superfamiglie e classi. Questi meccanismi possono dividersi grossolanamente in pompe e trasportatori, in base al fatto che usano direttamente, o no, l’ATP.
Se fate questa domanda ad un qualsiasi esperto nel settore vi dirà che ci sono migliaia di proteine che fanno ‘ordine’ tra i diversi ioni, e sono divise in famiglie, superfamiglie e classi. Questi meccanismi possono dividersi grossolanamente in pompe e trasportatori, in base al fatto che usano direttamente, o no, l’ATP. A questa domanda c’è una risposta più o meno ovvia. Poco prima dell’ischemia funzionava tutto come al solito, nulla lasciava presagire il disastro, e tutte le proteine risiedevano al loro nomale posto fino a che è mancata l’energia necessaria per il trasporto attivo degli ioni. Quando è iniziata a mancare l’energia l’efficienza del trasporto ionico si è ridotta mentre il disordine ionico dei
A questa domanda c’è una risposta più o meno ovvia. Poco prima dell’ischemia funzionava tutto come al solito, nulla lasciava presagire il disastro, e tutte le proteine risiedevano al loro nomale posto fino a che è mancata l’energia necessaria per il trasporto attivo degli ioni. Quando è iniziata a mancare l’energia l’efficienza del trasporto ionico si è ridotta mentre il disordine ionico dei  A questo punto del racconto io mi recherei sul luogo del delitto alla ricerca di qualche indizio e soprattutto di qualche risposta.
A questo punto del racconto io mi recherei sul luogo del delitto alla ricerca di qualche indizio e soprattutto di qualche risposta. Ritornando in ufficio c’è una cosa che non quadra… questo trasportatore passivo dove ha trovato tutta questa energia per espellere una quantità di
Ritornando in ufficio c’è una cosa che non quadra… questo trasportatore passivo dove ha trovato tutta questa energia per espellere una quantità di  Uhmm… Forse calunnie, leggendo bene qua e là i farmaci utilizzati per inibire NCX non sono molto specifici, agiscono anche su altri canali; magari NCX è stato coinvolto in qualcosa di più grande ed è stato usato come capro espiatorio. Improbabile che una proteina così letale possa essere conservata per milioni di anni durante l’evoluzione se non migliori sensibilmente il fitness dell’organismo.
Uhmm… Forse calunnie, leggendo bene qua e là i farmaci utilizzati per inibire NCX non sono molto specifici, agiscono anche su altri canali; magari NCX è stato coinvolto in qualcosa di più grande ed è stato usato come capro espiatorio. Improbabile che una proteina così letale possa essere conservata per milioni di anni durante l’evoluzione se non migliori sensibilmente il fitness dell’organismo. Le cose, da allora, non sono andate molto avanti, le pubblicazioni si sono rincorse tra di loro in un misto di ripetizioni e staccate con farmaci sempre più specifici e potenti. A questi articoli facevano seguito altri che descrivevano dell’effetto di queste sostanze sulla circolazione, ipertensione, inibizione di canali del
Le cose, da allora, non sono andate molto avanti, le pubblicazioni si sono rincorse tra di loro in un misto di ripetizioni e staccate con farmaci sempre più specifici e potenti. A questi articoli facevano seguito altri che descrivevano dell’effetto di queste sostanze sulla circolazione, ipertensione, inibizione di canali del  Analisi su analisi in diverse salse hanno dimostrato che questa proteina è fondamentale per alcuni meccanismi cardiaci e non solo, ma sicuramente esalta anche il danno ischemico al miocardio. E’ una circostanza difficile da spiegare in termini evoluzionistici e non è possibile capirne a fondo il meccanismo esatto.
Analisi su analisi in diverse salse hanno dimostrato che questa proteina è fondamentale per alcuni meccanismi cardiaci e non solo, ma sicuramente esalta anche il danno ischemico al miocardio. E’ una circostanza difficile da spiegare in termini evoluzionistici e non è possibile capirne a fondo il meccanismo esatto. 
 Come penso molti di voi possono intuire, esiste un numero inimmaginabile di odori, e la maggioranza di questi è causato da un mix di ‘odori primari’ in diversi rapporti, ma a complicare la situazione c’è che una molecola odorosa può agire su decine di recettori diversi con diversa specificità. I OR dei composti aminici, ad esempio, riconoscono solamente l’azoto primario, secondario o terziario con diversa efficacia, per cui gli odori di questi composti non possono essere discriminati con facilità e sembrano tutti molto simili. C’è da dire però che nonostante questa piccola sovrapposizione di segnali si possono discriminare con elevata sensibilità circa 10.000 odori diversi.
Come penso molti di voi possono intuire, esiste un numero inimmaginabile di odori, e la maggioranza di questi è causato da un mix di ‘odori primari’ in diversi rapporti, ma a complicare la situazione c’è che una molecola odorosa può agire su decine di recettori diversi con diversa specificità. I OR dei composti aminici, ad esempio, riconoscono solamente l’azoto primario, secondario o terziario con diversa efficacia, per cui gli odori di questi composti non possono essere discriminati con facilità e sembrano tutti molto simili. C’è da dire però che nonostante questa piccola sovrapposizione di segnali si possono discriminare con elevata sensibilità circa 10.000 odori diversi. Nel mondo animale, il non saper distinguere l’odore di una preda dall’odore del proprio predatore fa la differenza tra fare una buona colazione ed essere la colazione di qualcun altro. Anche riconoscere l’odore delle cose che si possono mangiare da quelle che è meglio evitare è fondamentale per la sopravvivenza, quindi i mammiferi durante l’evoluzione hanno accumulato più di 1.000 geni che sovraintendono il più misterioso dei 5 sensi. In pratica più del 3% del genoma dei mammiferi è deputato alla
Nel mondo animale, il non saper distinguere l’odore di una preda dall’odore del proprio predatore fa la differenza tra fare una buona colazione ed essere la colazione di qualcun altro. Anche riconoscere l’odore delle cose che si possono mangiare da quelle che è meglio evitare è fondamentale per la sopravvivenza, quindi i mammiferi durante l’evoluzione hanno accumulato più di 1.000 geni che sovraintendono il più misterioso dei 5 sensi. In pratica più del 3% del genoma dei mammiferi è deputato alla  Sapere quanti tipi di recettori sono presenti per cellula è fondamentale per capire quante aree ci dovremmo aspettare di trovare e per verificarlo potremmo ricorrere a tecniche avanzatissime di in situ hybridization, e di retrotrascrizione ed amplificazione per PCR su singola cellula. Ovviamente non sono tecniche facili e nemmeno tanto diffuse, ma gli esperti sono riusciti a dimostrare con questi esperimenti che ogni ORC esprime solamente un singolo OR.
Sapere quanti tipi di recettori sono presenti per cellula è fondamentale per capire quante aree ci dovremmo aspettare di trovare e per verificarlo potremmo ricorrere a tecniche avanzatissime di in situ hybridization, e di retrotrascrizione ed amplificazione per PCR su singola cellula. Ovviamente non sono tecniche facili e nemmeno tanto diffuse, ma gli esperti sono riusciti a dimostrare con questi esperimenti che ogni ORC esprime solamente un singolo OR. Secondo questa teoria la combinazione casuale o pseudocasuale di fattori trascrizionali per esprimere un singolo OR non può essere disturbata dalla coespressione di un OR transgenico scelto da noi. Per verificare questa teoria ‘deterministica‘, quindi, possiamo generare un topo transgenico in cui alcune ORC esprimono in maniera forzata un determinato OR scelto da noi e valutare se c’è coespressione.
Secondo questa teoria la combinazione casuale o pseudocasuale di fattori trascrizionali per esprimere un singolo OR non può essere disturbata dalla coespressione di un OR transgenico scelto da noi. Per verificare questa teoria ‘deterministica‘, quindi, possiamo generare un topo transgenico in cui alcune ORC esprimono in maniera forzata un determinato OR scelto da noi e valutare se c’è coespressione. Un’altra teoria che si è fatta strada nel tempo è basata sulla casualità della scelta del OR espresso (teoria stocastica). Per capirci immaginiamo un fattore trascrizionale unico che sia in grado di legare il promotore di tutti i geni dei OR e di consentirne l’espressione; tecnicamente può legarsi ad un solo OR e quindi può esprimere solo quello. Se il fattore trascrizionale non è molto efficiente nell’esprimere un OR si potrebbe spiegare come mai una ORC cambia OR nei primi stadi pur seguendo sempre la regola di esprimere un solo OR alla volta. In seguito, quando un OR espresso dà un forte segnale di funzione (feed-back) il fattore trascrizionale si fissa sul gene che sta trascrivendo fino allo stadio di maturazione.
Un’altra teoria che si è fatta strada nel tempo è basata sulla casualità della scelta del OR espresso (teoria stocastica). Per capirci immaginiamo un fattore trascrizionale unico che sia in grado di legare il promotore di tutti i geni dei OR e di consentirne l’espressione; tecnicamente può legarsi ad un solo OR e quindi può esprimere solo quello. Se il fattore trascrizionale non è molto efficiente nell’esprimere un OR si potrebbe spiegare come mai una ORC cambia OR nei primi stadi pur seguendo sempre la regola di esprimere un solo OR alla volta. In seguito, quando un OR espresso dà un forte segnale di funzione (feed-back) il fattore trascrizionale si fissa sul gene che sta trascrivendo fino allo stadio di maturazione. Se ci pensate, esiste un meccanismo di scelta molto simile che avviene nei linfociti. Queste cellule, però, non decidono l’anticorpo da esprimere in base a fattori trascrizionali, ma attraverso una ricombinazione genetica guidata. Si tratta di una piccola deviazione della teoria stocastica ed è anche risolutiva.
Se ci pensate, esiste un meccanismo di scelta molto simile che avviene nei linfociti. Queste cellule, però, non decidono l’anticorpo da esprimere in base a fattori trascrizionali, ma attraverso una ricombinazione genetica guidata. Si tratta di una piccola deviazione della teoria stocastica ed è anche risolutiva.
 Certamente la ricombinazione è da scartare ma fino ad ora niente ha smentito la casualità della scelta del OR. Tuttavia un gruppo di ricerca ha recentemente messo in discussione anche questa ipotesi granitica.
Certamente la ricombinazione è da scartare ma fino ad ora niente ha smentito la casualità della scelta del OR. Tuttavia un gruppo di ricerca ha recentemente messo in discussione anche questa ipotesi granitica. L’ultima domanda è ‘Cosa succede con il collegamento al cervello quando forziamo una cellula ORC ad esprimere un recettore specifico scelto da noi?’. Gli esperimenti mostrano che il collegamento cervello-recettore è perfetto, quindi ne consegue che il collegamento è basato solo sull’OR espresso.
L’ultima domanda è ‘Cosa succede con il collegamento al cervello quando forziamo una cellula ORC ad esprimere un recettore specifico scelto da noi?’. Gli esperimenti mostrano che il collegamento cervello-recettore è perfetto, quindi ne consegue che il collegamento è basato solo sull’OR espresso. Allora, per chi non avesse seguito le puntate precedenti, abbiamo introdotto un giallo misterioso dove delle cellule del cervello umano muoiono improvvisamente in seguito ad
Allora, per chi non avesse seguito le puntate precedenti, abbiamo introdotto un giallo misterioso dove delle cellule del cervello umano muoiono improvvisamente in seguito ad  Se dovessimo ricostruire cosa accade negli ultimi istanti di queste cellule, ci potremmo accorgere che le cellule della penombra moriranno entro qualche ora non riescono a gestire i flussi di
Se dovessimo ricostruire cosa accade negli ultimi istanti di queste cellule, ci potremmo accorgere che le cellule della penombra moriranno entro qualche ora non riescono a gestire i flussi di  Un ispettore che si trova in una scena del crimine molto complessa come quella descritta e che ha sentito la ricostruzione del danno analizzerebbe sicuramente tutta una batteria di proteine e di mRNA per capire costa stavano facendo i
Un ispettore che si trova in una scena del crimine molto complessa come quella descritta e che ha sentito la ricostruzione del danno analizzerebbe sicuramente tutta una batteria di proteine e di mRNA per capire costa stavano facendo i