Integrina αL β 2

Le integrine compongono un'importante famiglia di proteine, presenti praticamente in ogni cellula umana sono rintracciabili anche in moltissimi altri organismi.
Ma a cosa servono esattamente? Ad un primo sguardo appaiono come proteine integrali di membrana formate da un complesso dominio N-terminale extracellulare ed uno più piccolo C-Terminale intra-citoplasmatico, con la funzione di ancorare la cellula al complesso di molecole che la circondano e la sostengono: la matrice extracellulare.
Ma questa è solo una parte del fondamentale lavoro svolto dalle integrine, le quali in realtà risultano uniche data la loro capacità di trasportare messaggi sia da dentro la cellula all'esterno (inside-out signaling) che viceversa (outside-in signaling).
Vediamo meglio il meccanismo di azione.
Bisogna tener presente che un'integrina è composta da due sub-unità una α e una β.
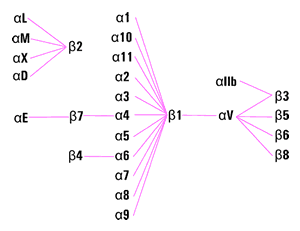
Nell'uomo esistono 18 diverse α e 8 β , ma non tutte si trovano associate tra loro, solo 24 combinazioni esistono effettivamente, o perlomeno sono state ad oggi individuate (Fig. 1).
Le due tipologie di subunità sono strutturalmente piuttosto diverse, particolarmente interessante è la struttura della α.
Questa ha in alcuni casi un dominio detto α I che, quando presente, si rivela necessario per l'interazione con i ligandi.
Inoltre contiene altri tre importanti domini, il cui nome fornisce già degli indizi sulla funzione: Thigh, Genu e Calf, cioè coscia, ginocchio e polpaccio.
È noto da tempo che le integrine hanno due possibili conformazioni: fissandole ed analizzandole in presenza di alte concentrazioni di ligando hanno una forma distesa, attiva, mentre fissandole in assenza di ligandi assumono una conformazione inattiva, ripiegata, detta a V [Takagi et al. , Cell 2002].
Il movimento di distensione avviene strutturalmente grazie al movimento dei domini "coscia" e "polpaccio", cioè Thigh e Calf, attorno a quello "ginocchio", Genu.
Quindi la struttura aperta viene assunta in presenza di alte concentrazioni di ligandi extra-cellulari, il che influenza anche le proprietà della parte intra-cellulare.
Questa è la base della segnalazione outside- in dato che la presenza del ligando cambia la capacità della parte intra-cellulare di legare diverse proteine come Fak o Src, le quali danno inizio a vie di segnalazione fondamentali.
Per avere un'idea dell'importanza ad esempio trasmettono messaggi di inibizione apoptotica o di attivazione mitotica.
Analogamente, in risposta a certi segnali cellulari, il legame di proteine come la Vinculina alla porzione citoplasmatica dell'integrina ne provoca il cambiamento conformazionale verso la forma attiva più affine per i ligandi esterni (segnalazione inside-out)[Hynes et al, Cell 2002].
Possiamo vedere questo sistema in azione in uno specifico fenomeno necessario per la risposta alle infezioni nel nostro organismo, l'attivazione e il legame dell'Integrina α L β 2.
Infatti quando si verifica un'infezione in un certo tessuto questo ha la capacità di richiamare globuli bianchi che normalmente si trovano nella circolazione sanguigna.
In particolare le cellule endoteliali nelle vicinanze del sito di infezione esprimono alcune glico-proteine di membrana dette selectine e in più secernono particolari chemochine.
Le selectine vengono riconosciute da altre molecole superficiali sui globuli bianchi formando un legame debole, molti legami di questo genere però riescono ad agire come un velcro rallentando l'avanzamento del leucocita nel circolo sanguigno.
Inoltre questo legame genera una segnalazione intracellulare che agisce sinergicamente con quella promossa dalle chemochine che, secrete dall'endotelio, trovano adeguati recettori sui globuli bianchi.
La trasduzione di questo segnale porta al legame di proteine alla parte citoplasmatica delle integrine α L β 2 che passano dalla conformazione a V a quella lineare attiva.
Strutturalmente questo coincide con l'abbassamento di una particolare α elica nella subunità α, in questo modo viene esposto un sito contenete un catione nel dominio necessario per il legame, il dominio αI.
Questo, così attivato, α diviene in grado di legare molecole cariche negativamente, e specificatamente si va a legare ad un residuo glutammato di una molecola superficiale espressa dall'endotelio nell'immediata prossimità dell'infezione: ICAM.
Questo legame è molto più forte di quello delle selectine e arresta l'avanzamento del leucocita provocando inoltre un'ennesima modificazione strutturale dell'integrina, che trasmette così un messaggio all'interno della cellula (outside-in), dando il là a tutte le modificazioni necessarie per attraversare l'endotelio e raggiungere il sito di infezione(Fig. 2).
A conferma di ciò modelli sperimentali murini deficienti di specifiche integrine ortologhe di α L e β 2 non rispondono correttamente alle infezioni[Wilson et al. , J. Immunology 1993].
Inoltra:
 |
Vota: 
|
|
