Vi porto a laboratorio con me. Pronti? (parte I)
Anni e anni di serie di CSI ci hanno fatto credere che facendo fare un giro in centrifuga a qualsiasi liquido colorato contenuto in una provetta fosse possibile ottenere in dieci minuti qualsiasi sequenza di DNA, identificazione di microorganismi e ogni altra informazione reperibile in un campione biologico.
Beh, non funziona proprio così. Il “lavoro sporco” al bancone è lungo, laborioso e complicato. E maledettamente divertente. Oggi passiamo una giornata in laboratorio: ecco come si fa una estrazione di proteine con loro identificazione!
In questo articolo sorvolerò su tutto quello che potete trovare da qualsiasi altra parte, per soffermarmi maggiormente sulla parte pratica della faccenda. Ad esempio, non perderò una pagina per spiegarvi cosa sono le proteine, di cosa sono fatte o come vengono prodotte, ma me la sbrigherò dicendovi che sono polimeri di amminoacidi, montati assieme a formare i mattoncini che costituiscono cose diversissime tra loro come l’emoglobina, le unghie, i muscoli, il macchinario molecolare che trasmette i segnali luminosi nell’occhio, i capelli, gli enzimi digestivi e il moccio del naso.
Oggi estrarremo le proteine da un pezzettino di aorta. Con estrazione intendo un vero e proprio procedimento che le separerà dagli altri costituenti chimici del tessuto (DNA, RNA, zuccheri, lipidi e varie altre molecole), per fornircele in un formato comodo per farci tutto quello che vogliamo: una soluzione acquosa.
Il tessuto, immerso nel buffer di lisi (che contiene reagenti che solubilizzano le proteine e contemporaneamente inattivano gli enzimi intracellulari che le sminuzzano o le digeriscono, sennò non avremmo nulla da analizzare), viene omogenato con un apposito frullatore, che ci sta giusto giusto dentro una provetta da 2 ml. Potrei alternativamente usare un potter o non fare nulla se lavorassi con un tessuto un po’ più morbido e procedere direttamente al passo successivo.
L’arnese che vedete qui (l’affare a punta sulla destra nella scatola di legno) è un sonicatore: emette degli ultrasuoni ad elevata intensità che, con estrema gentilezza, sbrindellano il tessuto. Nello specifico, la punta dell’asta di metallo è immersa nella provetta che contiene l’omogenato di tessuto: vibrando ad altissima frequenza il tessuto viene ulteriormente maciullato per stress meccanico. Le proteine resistono bene a questo tipo di insulto fisico, mentre DNA e RNA vengono sbrindellati in pezzettini piccoli. Se dovete estrarre anche gli acidi nucleici da un campione, evitate di sonicarlo!
L’operazione nel dettaglio: per accomodare il tutto ho utilizzato un becker pieno di ghiaccio. Oltre a permettermi di posizionare correttamente la provetta rispetto alla punta di metallo, il tutto rimane al freddo, impedendo così che le proteine in via di estrazione si scaldino troppo.
Dopo aver trattato male il nostro tessuto, molte delle proteine sono state strappate da dove erano e sono entrate in soluzione. Dobbiamo liberarci delle schifezze insolubili e dei detriti cellulari e per fare ciò centrifughiamo per bene il contenuto delle provette. Il rotore della centrifuga roteando molto velocemente (nella foto il settaggio è a 8000 rotazioni per minuto, ma questo modello arriva a 13200) “simula” un improvviso aumento di forza di gravità, equivalenti con questo rotore a qualcosa come 16000 volte l’intensità normale dell’accelerazione gravitazionale a cui siamo tutti sottoposti. Infilato in una provetta ed accelerato dentro a questa centrifuga, io peserei qualcosa tipo 960 tonnellate.
Controluce (quelle cose strane sullo sfondo sono dei banalissimi neon bianchi del soffito, che la macchina digitale ha reso artisticamente) osserviamo il risultato della centrifugata. La roba sul fondo della provetta è chiamato pellet; nel caso specifico dell’estrazione di proteine, è quello che non vogliamo. Quello che ci interessa è la soluzione acquosa di proteine che si trova nel liquido surnatante! Per concentrare le proteine ho utilizzato una quantità abbastanza piccola di buffer di lisi: 150 microlitri (150 milionesimi di litro – 150 µl).
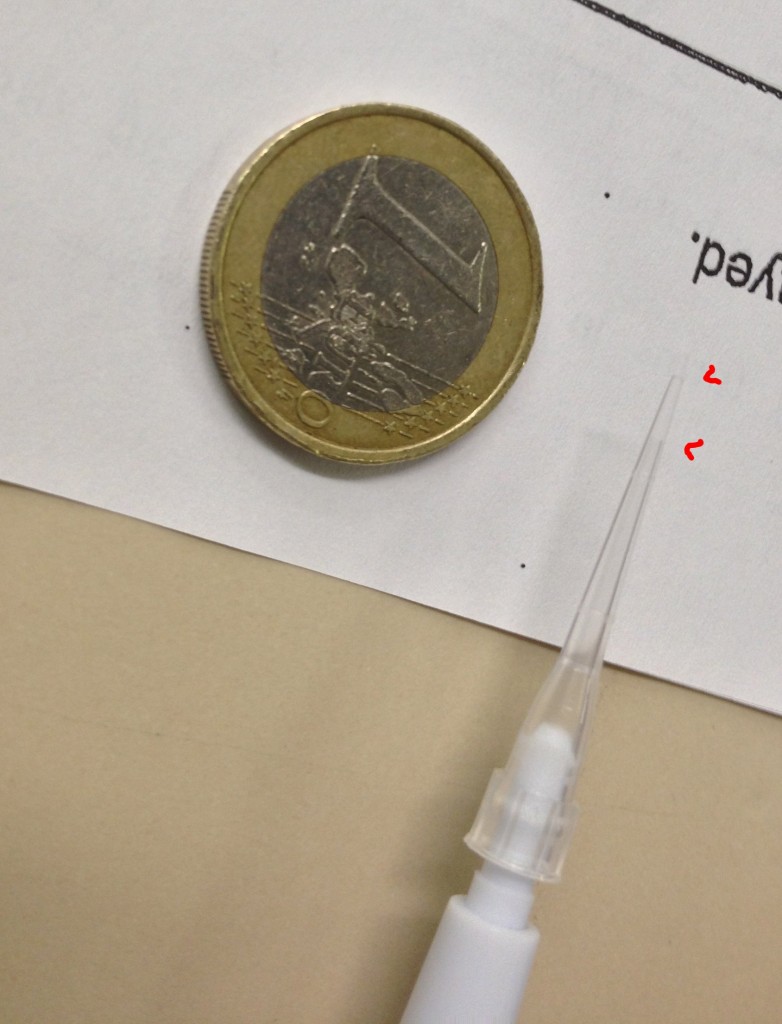
In laboratorio si lavora quotidianamente con volumi che possono apparire anche molto piccoli. In figura potete apprezzare un milionesimo di litro, ossia un microlitro (o 1 µl). Nel puntale è contenuta esattamente quella quantità di liquido, con i potenti mezzi a mia disposizione ho sottolineato dove il microlitro di liquido si trova e contrasta col foglio di carta sottostante. Molti reagenti (soprattutto enzimi in soluzione) di uso comune sono utilizzati nelle reazioni in volumi di microlitri o meno: vi potreste stupire dell’infinità di cose che possono stare in un volume di liquido così apparentemente piccolo!
Prima di poter essere utilizzate, le proteine appena estratte dovranno essere dosate. Ci sono vari metodi per farlo, ma più o meno si tratta di diluire il nostro liquido e aggiungere a questa diluizione un cocktail di reagenti, che diventerà tanto più colorato tante più proteine sono contenute nella nostra diluizione. Nel mio caso, ho preparato due diluizioni (1:300 e 1:600 – ho quindi diluito trecento e seicento volte qualche microlitro del mio estratto proteico): come vi dicevo prima, in un microlitro di liquido può essere contenuta davvero tanta roba!
Dopo l’aggiunta del reattivo, ecco come si presenta una piastra da 96 pozzetti. Questa viene inserita in uno spettrofotometro (un affare che guarda quanto è torbida/opaca una soluzione ad una specifica lunghezza d’onda e restituisce un valore numerico della lettura) che produce (nel mio caso) un fogliettino con tanti numeretti. Con qualche calcolo, paragonando le letture a pozzetti di riferimento in cui so esattamente quanta proteina c’è dentro, posso calcolare per interpolazione la concentrazione ignota dei miei campioni.
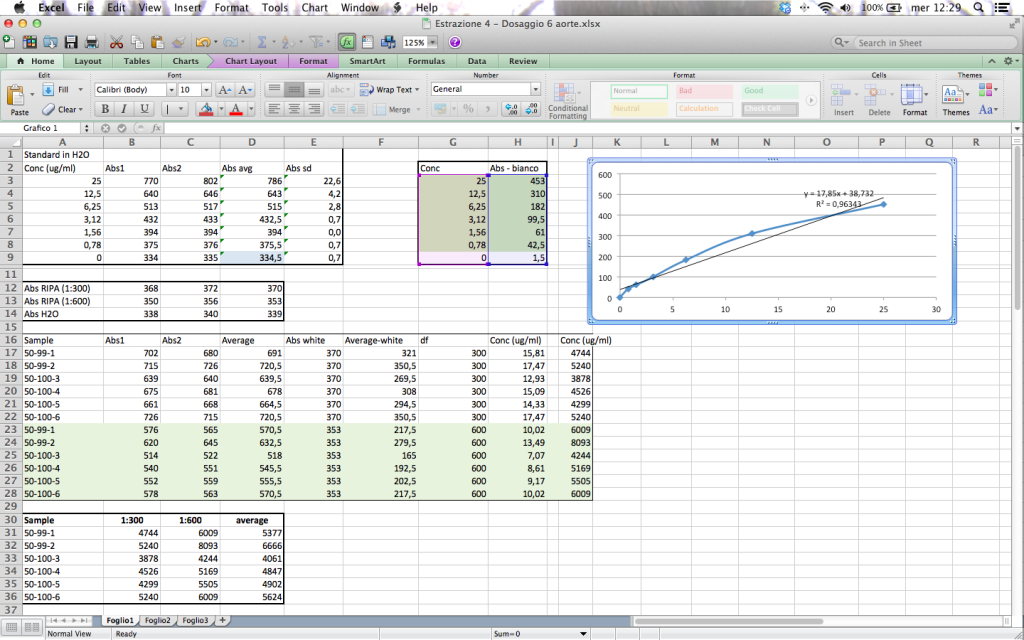
Naturalmente, è molto più comodo fare tutto con il computer! Ecco una vera quantificazione che potete fare con qualsiasi foglio di calcolo. Abbiamo (faticosamente) estratto circa 5 microgrammi/microlitro di proteine per campione. Permettetemi di sottolineare l’ovvio: non tutte le proteine saranno presenti allo stesso modo nella nostra miscela; se tritate le macchine di un parcheggio ottenete una gioiosa accozzaglia di parti meccaniche ma in proporzioni variabile. Ci saranno ad esempio tante lampadine, meno gomme e ancora meno volanti.
E’ giunto però ora il momento di utilizzare in qualche modo l’estratto che abbiamo preparato: quello che ho in mente è separare le proteine in base al loro peso, e riconoscerne successivamente qualcuna lanciandogli contro degli anticorpi.
Ma questa è una procedura che riserviamo per la prossima puntata…
Piermatteo
Tag:amminoacidi, biologia molecolare, diagnostica, estrazione, Immunoblotting, laboratorio, polimeri, proteine, tecniche di laboratorio, Western blotting, wet biology
seguici anche su Facebook!









Piermatteo, alla fine non ci hai detto cosa fosse quella cosa cruenta con cui hai colororato il tuo Western Blot. Suppongo sia un bellissimo Rosso Ponceau…
Aaah spoiler! :) L’articolo l’avevo immaginato come un unico, ma poi ho realizzato che era un papiro troppo lungo e ho deciso di spezzarlo in due! Un sacco di cose cruente nella prossima puntata! ^_^
Bellissimo articolo! Non vedo l’ora di leggere il seguito ^_^
[...] (Per assorbire tutta la scienza possibile da questo post è consigliabile leggere anche la prima punt…) [...]
Che bello leggere questo intervento, e quanti ricordi sono tornati: quelli della preparazione della tesi, in cui anche io ho cercato enzimi e maneggiato strumenti simili. Ora insegno e sono lontano da quelle pratiche (se va bene, in certe scuole riesci a preparare un vetrino di cellule di mucosa orale o di batteri dello yoghurt e, col colorante portato da me stesso, le colori pure!!), ma vedo che molte cose sono rimaste simili: CSI aveva ammaliato un pò anche me. Leggere OMG è sempre un piacere e ti fa stare in contatto con il modo reale di fare e intendere la scienza. Utile per discutere coi ragazzi!
Che articolo affascinante, come del resto lo è il mondo della scienza… Bello che possa essere resa comprensibile e accessibile anche ai non addetti ai lavori, grazie a blog come questo :)
Piermatteo, posso fare il puntiglioso?
Lo spettrofotometro non è “un affare che guarda quanto è torbida/opaca una soluzione ad una specifica lunghezza d’onda”.
Bensì “un affare che guarda quanto è trasparente/assorbente una soluzione ad un specifica lunghezza d’onda”.
Infatti ti risponde dandoti la trasmittanza/assorbanza della soluzione.
Cmq bel pezzo,
corro a leggere l’altra parte.
ciao
[...] L’ultima volta abbiamo estratto proteine da un campione biologico, e le abbiamo utilizzate in qualche esperimento. Come probabilmente saprete, le proteine sono sintetizzate dai ribosomi che incastrano assieme amminoacidi l’uno dopo l’altro in lunghe (o corte :P) catene seguendo il progetto scritto sull’RNA messaggero; a sua volta quest’ultimo viene ricopiato dal progetto originale che risiede nel nucleo della cellula, nel DNA. [...]