Vi porto a laboratorio con me. Pronti? (parte II)
Nella puntata precedente abbiamo visto come frullare le cellule per estrarre le proteine.
Adesso vediamo insieme un paio di giochini interessanti per analizzare queste simpatiche molecole. Cominciamo!
Separare le proteine in base al loro peso è un po’ come setacciare la terra per separare i granellini fini dai sassi: quello di cui abbiamo bisogno è un setaccio a maglie un po’ più piccole di quelle che si trovano da Leroy Merlin. Ci serviamo di una miscela di acrilamide e poliacrilamide, che polimerizzando costruisce una rete con le caratteristiche adatte.
L’intelaiatura di plastica che vedete tiene in posizione due vetri separati da uno spessore variabile (da 0,75 a 1,5 mm) dentro cui viene colata la soluzione di poliacrilamide che diventerà il setaccio (gel) che separerà le nostre proteine.
Come faccio a sapere quando la mix è polimerizzata perfettamente ed è pronta per essere utilizzata? Semplicemente ne preparo in più: anche i meno attenti (incluso me) possono facilmente riconoscere il diverso comportamento di una sostanza allo stato liquido e allo stato solido et voilà: il gioco è fatto*!
A questo punto preparo i campioni per il loro caricamento: quello che serve è denaturare le proteine (ossia “disannodarle” e renderle lineari facendo loro perdere la loro forma**: un po’ come quello che fate quando togliete dalla tasca l’auricolare del telefono che inspiegabilmente è diventato un globo nodoso e pazientemente lo ripristinate allo stato di filo lineare). Il procedimento per farlo è molto complicato e presuppone l’utilizzo e la comprensione di alcune proprietà termodinamiche e delle alterazioni indotte nelle molecole da questi barbatrucchi termodinamici: il fenomeno è noto ai più sgamati come bollitura.
Nelle provette che vedete c’è un detergente (SDS, o sodio dodecil solfato, o sodium lauryl sulfate: è molto probabile l’abbiate letto distrattamente per sbaglio nella lista degli ingredienti del vostro bagnoschiuma) che serve ad aiutare la denaturazione delle proteine ma soprattutto a ricoprirle uniformemente di una carica elettrica negativa. Approssimativamente, il legame tra l’ SDS e il “filo” amminoacidico che costituisce le proteine è direttamente proporzionale alla lunghezza della proteina (“filo di amminoacidi”) e non a singoli (differenti) amminoacidi che lo costituiscono. Dato che è il l’applicazione di un campo elettrico che spinge le proteine nel setaccio, e che queste hanno cariche diverse date dai diversi amminoacidi che le costituiscono, è necessario far indossare indossare alle proteine un cappotto di SDS che mascheri le loro cariche e le renda tutte uguali (stessa carica per unità di lunghezza). Fatto questo, si carica il gel e si attacca la corrente!
I gel colati tra i due vetri sono stati messi all’interno di un altro affare di plastica, una specie di tanica che contiene una soluzione nella quale sono immersi gli elettrodi. Potete ammirare un filo platino (o così mi hanno detto :P) teso orizzontalmente nella parte bassa dell’apparato, e se aguzzate la vista anche le bollicine gassose che nascono sul filo per l’azione del passaggio della corrente e l’interazione con gli elettroliti del running buffer. Il marcatore colorato sulla sinistra ci aiuta a monitorare la corsa. Dentro ci sono delle proteine di vario peso colorate con colori differenti: man mano che attraversano il gel si separano in bande distinte, perchè ogni proteina ha un peso differente, e quindi scorrerà nel setaccio più o meno velocemente a seconda di quanto è più o meno piccina. Mentre i gel corrono è un’ottimo momento per andare a sgranocchiare qualcosa!
Alla fine della corsa, le proteine si saranno separate in base al loro peso: le più grandi avranno migrato poco, mentre le più leggere saranno arrivate fino in fondo al gel (tocca a voi ricordarvi di togliere la corrente…). Dentro al gel però è complicato studiarle: è preferibile trasferirle su una superficie sulla quale è più semplice addizionare reagenti. Quello che vedete in figura è un trasferimento in atto: ho assemblato un sandwich in cui ho messo a contatto il gel, estratto dai vetri, con un foglio di nitrocellulosa su cui voglio trasferire le proteine dal gel – aiutandomi col solito campo elettrico. Il tutto infilato tra fogli di carta, spugnette, il solito liquido con dentro gli elettroliti e… al fresco in ghiaccio.
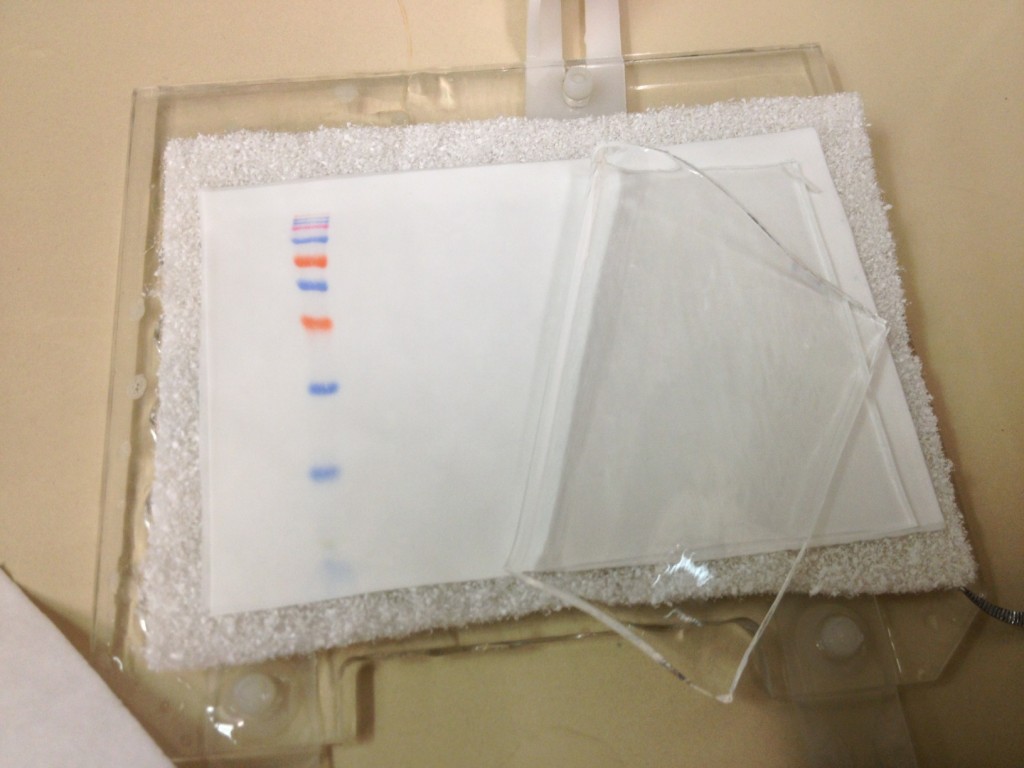
In questa immagine potete osservare l’anima in plastica dell’apparato del sandwich: le parti importanti sono il gel (che potete osservare “libero”) e il foglio di nitrocellulosa su cui poggia il gel, in cui potete ammirare il trasferimento delle singole bande del marcatore di peso molecolare: ciascuna corrisponde ad una ben precisa proteina. Se volete, potete individuarle e scoprire chi sono guardando sul foglietto illustrativo del marker.
La parte bianca contiene le proteine dei miei campioni – che non sono colorate e non si riesce quindi a vederle ad occhio nudo. Per convincervi che sono lì (e farmi un idea se il trasferimento è venuto bene), le coloro con un colorante (che si lega reversibilmente alle proteine) chiamato Red Ponceau: vi faccio solo immaginare di che colore sia.
In una vaschetta verso il Ponceau, per poi mettere il tutto su un agitatore qualche minuto.
Come potete vedere, il foglio di nitrocellulosa non è affatto vuoto: le proteine sono state trasferite sulla nitrocellulosa, e sono tutte pronte per essere investigate. Qualche lavaggio con TBS (una soluzione salina a pH fisiologico) sarà più che sufficiente ad eliminare il colorante e a restituirci la nitrocellulosa bianca come nella foto precedente.
La passeggiata in laboratorio che state facendo con me è illustrativa della metodica e non voglio soffermarmi sui milioni di perché che ci portano a fare queste analisi. Quello che solitamente interessa il ricercatore è avere informazioni su qualcuna delle proteine contenute nella soluzione, come per esempio quante proteine di un determinato tipo sono presenti nell’estratto. La cosa non è banale: dobbiamo trovare qualcosa che reagisca specificamente con la nostra proteina che ci interessa e che ignori le altre, e dobbiamo poi essere in grado di visualizzare questo qualcosa che reagisce con la nostra proteina.
Senza addentrarci troppo nella questione, vi svelerò che il magico reagente capace di fare questo è un anticorpo. Gli anticorpi fanno proprio questo di mestiere: riconoscono specifiche porzioni di una proteina in maniera molto specifica. Nella normale vita di tutti i giorni, funzionano da “bandierine” per le cellule del sistema immunitario; nella normale vita di laboratorio di tutti i giorni funzionano da “bandierine” per i nostri sistemi di misurazione. Lo schema è semplice: useremo una soluzione che contiene degli anticorpi che riconoscono specificamente una proteina presente tra le migliaia sul foglio di nitrocellulosa, e riveleremo questo anticorpo con un altro anticorpo, modificato in modo da emettere un segnale che noi possiamo vedere. Questa figura è esemplificativa della semplicità concettuale della metodica.
Di questa parte non ho fatto fotografie: si tratta di mettere il foglio di nitrocellulosa in una vaschetta (come quella che avete visto del Ponceau) e cambiare ad intervalli regolari delle soluzioni. Alla fine, uno speciale reattivo fa in modo che l’ultimo anticorpo emetta luce: il nostro compito è quello di sistemare il foglio di nitrocellulosa in una cassetta di esposizione assieme ad una lastra per radiografie (uguale a quella che se siete sfortunati vi viene consegnati in seguito ad un esame radiografico) per catturare questo segnale luminoso***.
Questa è una esposizione in camera oscura: ho impressionato la lastra e l’ho sviluppata, e osservo controluce (la fioca luce rossa che ci permette di vedere qualcosa in camera oscura) come sta andando. Questo esperimento non è venuto proprio un bijoux: ci sono un po’ troppe bande, e in questo caso provvederò ad esporre la lastra per un tempo minore per non popolare la mia lastra di aspecifici (sulla carta funziona tutto perfettamente: nella pratica di ogni giorno la buona riuscita di un esperimento dipende da una miriade di fattori, non ultimo il fattore C).
Questo il gradevole aspetto della nostra camera oscura. Sparpagliati sul bancone i miei “attrezzi”, e sulla destra la tanica con i liquidi di sviluppo.
Questa è la cassetta di esposizione di cui vi parlavo. I fogli di nitrocellulosa sono sistemati al suo interni, coperti da un foglio di pellicola (di quelle del supermercato) su cui (al buio!) viene posizionata l lastra radiografica; al termine dell’impressionamento della lastra, questa viene sviluppata. Una volta asciutta, utilizzando i bordi della cassetta come punti di riferimento (un metodo più spiccio e più error-free di esoterici segni con pennarello fatti al buio), riesco a risalire correttamente da quale punto del foglio di nitrocellulosa si è originato il segnale luminoso.
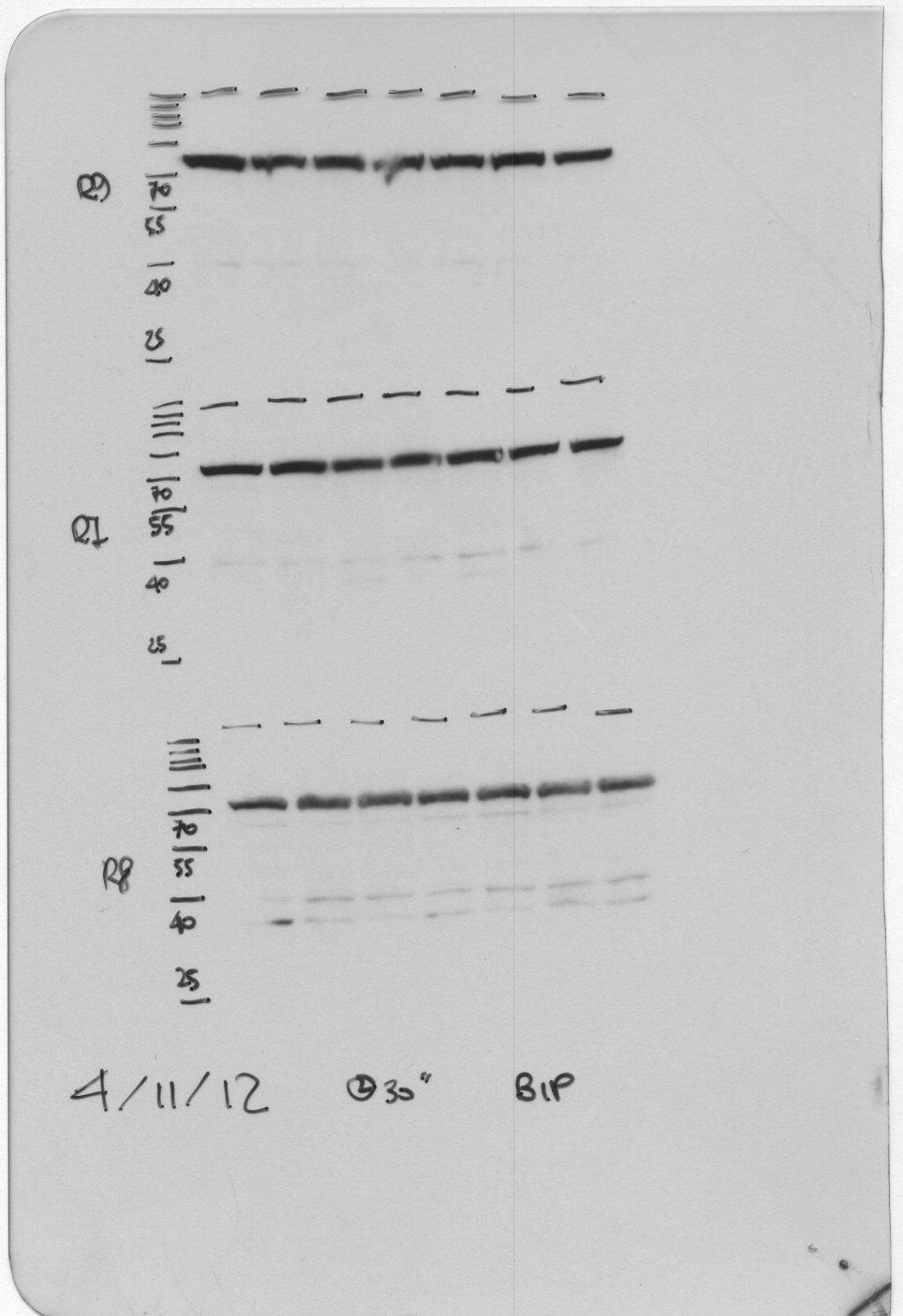
Ecco qua: il prodotto finito! Dopo aver sviluppato la lastra in camera oscura, ed aver ricalcato il contorno dei fogli di nitrocellulosa col pennarello indelebile e segnato le bande del marcatore (che potete vedere sulla sinistra, per alcune bande è anche indicato il peso in migliaia di Dalton), osservo il risultato finale dell’esperimento. Dopo un’esposizione di 30 secondi (indicata sulla lastra), osservo a circa 70 KDa una netta banda per ogni corsia (lane). Ogni corsia (in verticale) si origina naturalmente da un singolo estratto proteico, in seguito alla corsa di tutte le proteine del campione (che potete vedere nel loro insieme con la colorazione al Ponceau, come abbiamo visto prima). Grazie agli anticorpi, di tutte le proteine presenti nel campione in questo caso ne visualizziamo una soltanto: BiP. E’ possibile quantificare con appositi programmi l’intensità delle singole bande e confrontarle con altre proteine di riferimento (che si suppone non varino nelle varie condizioni sperimentali) ed ottenere informazioni su quanta proteina (di un singolo tipo quindi) è presente nel nostro campione.
Questo piccolo tour nel mondo delle proteine termina qui, per stavolta. Come mi disse il mio prof di chimica inorganica alla fine del corso, “non pensiate di conoscere la chimica. Avete appena iniziato ad apprendere i primi rudimenti che potrete utilizzare per incominciare ad addentrarvi nella materia”; parafrasandolo vi posso dire che quanto abbiamo visto non è che un piccolo dardo nella faretra dello sperimentatore.
Piermatteo
Noticine a piè pagina:
* Il gel è in realtà composto da due porzioni a “durezza” differente. Il primo ad essere preparato, e che occupa la maggior parte del volume, è il gel in cui le proteine vengono veramente separate (running gel); il secondo, molto più morbido (a maglie molto larghe) viene colato sopra al primo (stacking gel) e ha due funzioni: alloggiare il pettine che servirà da stampo per lasciare dei buchi (pozzetti) in cui caricare il campione (le proteine che abbiamo estratto), e “impacchettare” tutte le proteine assieme nel fronte di corsa prima della loro separazione vera e propria.
** Le proteine sono polimeri lineari di amminoacidi, per lo più: Questi “fili” si ripiegano su loro stessi per virtù della distribuzione delle differenti cariche elettriche dei vari amminoacidi in modo più o meno complicato; in questo modo la proteina matura non assomiglia ad un filo ma assume una forma differente che le permette di svolgere svariate funzioni.
*** In alternativa, si possono utilizzare dei sistemi digitali, ma l’analogico in questo caso conserva ancora molto del suo fascino!
Tag:amminoacidi, biologia molecolare, diagnostica, estrazione, Immunoblotting, laboratorio, polimeri, proteine, tecniche di laboratorio, Western blotting, wet biology
seguici anche su Facebook!












Grazie per questa avventura! :)
Una futura biologa
Ma figurati, sono molto contento di averti interessato! Resta sintonizzata perchè seguiranno altri articoli su molte altre tecniche!
Grazie mille per questo articolo, l’ho trovato davvero molto interessante!
Keep them coming!
- K
[...] [...]